
题目列表(包括答案和解析)
12. S(单斜)和S(正交)是硫的两种同素异形体。
 已知:① S(单斜,s)+O2(g) === SO2(g) △H1=- 297.16 kJ·mol-1
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=- 297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法正确的是( )
A.△H3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)=== S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
11. 将V1 mL 1.00 mol·L-1HCl溶液V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
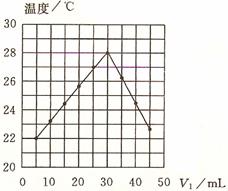 A.做该实验时环境温度为22 ℃
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
10. 已知H2(g)+Cl2(g)=== 2HCl(g) △H = -184.6 kJ/mol,则反应HCl(g)==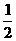 H2(g)+
H2(g)+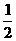 Cl2(g)的△H为( )
Cl2(g)的△H为( )
A. +184.6 kJ• mol-1 B. -92.3 kJ• mol-1
C. -369.2 kJ• mol-1 D.+92.3 kJ• mol-1
9.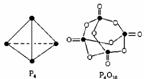 白磷与氧可发生如下反应:P4+5O2===
P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的
白磷与氧可发生如下反应:P4+5O2===
P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的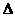 H,其中正确的是( )
H,其中正确的是( )
A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
8. 我国发射“神五”所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料。NO2为氧化剂,反应生成N2和水蒸气。已知:
① N2(g)+2O2(g) === 2NO2(g) △H=+67.7kJ• mol-1,
② ②N2H4(g)+O2(g) === N2(g)+ 2H2O(g) △H= -534 kJ• mol-1。
下列关于肼和NO2反应的热化学方程式中正确的是 ( )
A. 2N2H4(g)+2NO2(g) === 3N2(g) + 4H2O (l) △H= -1135.7 kJ• mol-1
B. 2N2H4(g)+2NO2(g) === 2N2(g) +4H2O(l) △H= -1135.7 kJ• mol-1
C. N2H4(g)+NO2(g) === 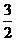 N2(g) +2H2O(g
) △H= -1135.7 kJ• mol-1
N2(g) +2H2O(g
) △H= -1135.7 kJ• mol-1
 D. 2N2H4(g)
+
2NO2(g) === 3N2(g)+4
H2O (g) △H= -1135.7 kJ•
mol-1
D. 2N2H4(g)
+
2NO2(g) === 3N2(g)+4
H2O (g) △H= -1135.7 kJ•
mol-1
7. 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·mol-1、1 411.0kJ·mol-1和1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2 kJ·mol-1 B. +44.2 kJ·mol-1
C. -330 kJ·mol-1 D. +330 kJ·mol-1
6. 已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g) === 2P2O5(s) △H = -a kJ• mol-1
4P(红磷,s)+5O2(g) === 2P2O5(s) △H = -b kJ• mol-1
若a、b均大于零,则a和b的关系为( )
A.a<b B.a=b C. a>b D.无法确定
5. 已知:(1)Zn(s)+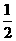 O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
(2)2Ag(s)+ 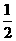 O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1 C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
4. 已知下列热化学方程式:
Zn(s)+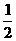 O2(g)=== ZnO (s) △H= -
Q1 kJ• mol-1 ①
O2(g)=== ZnO (s) △H= -
Q1 kJ• mol-1 ①
Hg(l) +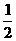 O2(g)=== HgO (s) △H=
-Q2 kJ• mol-1 ②
O2(g)=== HgO (s) △H=
-Q2 kJ• mol-1 ②
Zn(s) +HgO (s) === Hg(l)+ ZnO (s) △H= -Q3 kJ• mol-1 ③
③中的Q3值为( )
A. Q2 -Q1 B. Q1 +Q2 C. Q1- Q2 D. -Q1- Q2
3. 相同温度下,有下列三个热化学方程式:
(1)H2(g)+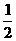 O2(g)=== H2O(g) △H1=
-Q1 kJ• mol-1
O2(g)=== H2O(g) △H1=
-Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(g)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是 ( )
A. Q1=Q2<Q3 B. Q2>Q3 > Q1
C. Q3> Q2> Q1 D. Q1=Q2=Q3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com