
题目列表(包括答案和解析)
2.下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
B.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁
C.钢铁表面常易锈蚀生成Fe2O3·nH2O
D.金属的腐蚀主要是电化学腐蚀
1.下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
15. 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H=
 (用含E1、E2的代数式表示)。
(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 。
 (3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是
。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是
。
14. 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
_______________________________________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
13. 在一定条件下A与B反应可生成C和D,其能量变化如图:
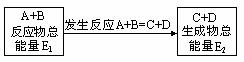
(1)下列有关反应A+B===C+D的说法正确的是 。
A. 反应前后原子的种类和数目一定不变
B. 该反应若有能量变化,则一定是氧化还原反应
C. 该反应若为放热反应,则不需加热反应就一定能自发进行
D. 反应物的总质量与生成物的总质量一定相等,且遵循能量守恒
(2)若E1<E2,则生成物的总能量 (填“>”、“<”或“=”)反应物的总能量,为 (填“吸热”或“放热”)反应。
12.化学反应N2+3H2=2NH3的能量变化如下图所示,该反应的热化学方程式是( )

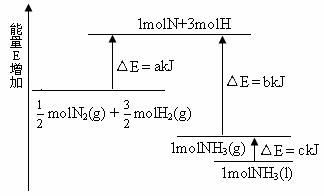
A. N2(g)+3H2(g) === 2NH3(1) △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g) === 2NH3(g) △H=2(b-a)kJ·mol-1
C. 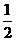 N2(g)+
N2(g)+ H2(g) === NH3(1) △H=(b+c-a)kJ·mol-1
H2(g) === NH3(1) △H=(b+c-a)kJ·mol-1
D. 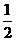 N2(g)+
N2(g)+ H2(g) === NH3(g) △H=(a+b)kJ·mol-1
H2(g) === NH3(g) △H=(a+b)kJ·mol-1
11. 已知 :
(1)H2(g)+ O2(g) ===H2O(g) △H1=a
kJ•mol-1
O2(g) ===H2O(g) △H1=a
kJ•mol-1
(2)2H2(g)+ O2(g) ===2H2O(g) △H2=b kJ•mol-1
(3)H2(g) + O2(g) ===
H2O(l) △H3=c
kJ•mol-1
O2(g) ===
H2O(l) △H3=c
kJ•mol-1
(4)2H2(g)+O2(g) ===2H2O(l) △H4=d kJ•mol-1
下列关系式中正确的是( )
A.a﹤c﹤0 B.b﹥d﹥0 C.2a= b﹤0 D.2c= d﹥0
10. 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1 mol H―H键断裂时吸收热量为( )
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
9.已知:H2(g)+F2(g) === 2HF(g) △H=-270 kJ· mol-1,下列说法正确的是( )
A.2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1 mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270 kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
8. 分析右面的能量变化图,判断下列选项中正确的是( )
分析右面的能量变化图,判断下列选项中正确的是( )
A. 2A(g)+B(g) === 2C(g) △H<0
B. 2A(g)+B(g) === 2C(g) △H>0
C. 2A+B=== 2C △H<0
D. 2C=== 2A+B △H<0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com