
题目列表(包括答案和解析)
34.以下是元素周期表的示意图。A、B、C、D、E、F均为短周期元素,请根据题示信息判断元素,再将相应元素符号填在周期表的合适的位置上,并回答下列问题:


⑴ 元素A的单质在加热条件下与碱反应:3A+6OH- 2A2-+AO32-+3H2O。
2A2-+AO32-+3H2O。
⑵ 元素B的气态氢化物与最高价氧化物对应的水化物之间可以反应生成盐,该盐在实际生活中的一种用途为
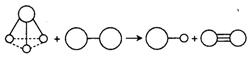 ⑶ 元素C与B的单质可以构成如下图所示的置换反应,图中生成的两种气态分子的相对分子质量
之比为1.30︰1。
⑶ 元素C与B的单质可以构成如下图所示的置换反应,图中生成的两种气态分子的相对分子质量
之比为1.30︰1。
⑷ 元素D与E的单质和化合物之间在一定条件下存在反应:2E+DO2=2EO+D,其中DO2为直线形的非极性分子。DO2的电子式为 。
⑸ 元素F的原子半径比E小,元素F的单质既能与强酸反应,又能与强碱反应,且元素F的单质可以在高温条件下还原三氧化二铁。该反应的化学方程式为
Fe在周期表中的位置是 。
33.A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
⑴ 用电子式表示B、F两元素形成化合物的过程
⑵ A、C两元素的化合物与B的氢氧化物反应的离子方程式为
⑶ D气态氢化物的稳定性 (填“大于”、“小于”)E的气态氢化物的稳定性。
32.一瓶无色气体可能由CO2、HCl、NH3、NO2、NO中的一种或几种组成,将此气体通过盛有浓硫酸的洗气瓶,发现气体的体积减小了一部分,继续通过装有Na2O2固体的干燥管,发现从干燥管中出来的气体呈红棕色。再将该气体通入盛满水且倒立于水槽中的试管中,最后发现试管中仍充满液体,请回答:
⑴ 原气体一定含有 一定不含有
⑵ 由最终结果可知原气体中 和 气体的体积比为
31.在化学实验中,有时一套装置可以有多种用途,用如图装置就可以制取多种气体,A是无色液体,B烧瓶内可以放固体,也可以放液体。请回答下列问题:
⑴ 若A是浓NH3·H2O,B内放固体 (化学式),
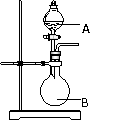 可以快速制NH3,该反应的化学方程式为:
可以快速制NH3,该反应的化学方程式为:
⑵ 若A是较浓的H2SO4,B内放Na2SO3固体,可以制取SO2,
该反应的化学方程式为:
 ⑶ 若A是浓盐酸,B内放浓H2SO4,可以快速制
(化学式),此过程是利用了浓H2SO4
⑶ 若A是浓盐酸,B内放浓H2SO4,可以快速制
(化学式),此过程是利用了浓H2SO4
的 性。
⑷ 若A是稀盐酸,B内放难溶于水的黑色固体 (化学式),可以制取H2S,
 该反应的离子方程式为:
该反应的离子方程式为:
⑸ 若A是浓硝酸,B内放足量的Cu片,加入A后,剧烈反应,刚开始放出红棕色气体,反应过
程中生成气体的颜色逐渐变浅,写出此过程中所发生反应的离子方程式:
⑹ 若A是 (化学式),B内放黑色粉末 (化学式),可以快速制取O2,
该反应的化学方程式为:
若A是 (化学式),B内放淡黄色粉末 (化学式),也可以快速制取O2,
该反应的化学方程式为:
⑺ 若A是浓盐酸,B内放KMnO4固体,可以快速制Cl2,请配平下面化学方程式:
KMnO4 + HCl(浓) -- KCl + MnCl2 + Cl2↑+ H2O
30.已知Ba(AlO2)2可溶于水。如图表示的是Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
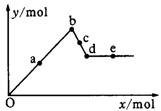 A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+一定大于OH-
第II卷(非选择题)
29.氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是( )
A.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.用磁铁矿炼铁的反应中,1mol Fe3O4被CO还原成Fe,转移9mole-
D.铝热法还原铁的反应中,放出的热量能使铁熔化
28.将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于( )
A.22.4bc×10-3 B.44.8bc×10-3
C.22.4(3a-4bc×10-3) D.22.4(3a-4bc)×10-3
27. 将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:
X(g)+Y(g)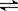 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,X的体积分数减小
B.增大压强,Z的浓度不变
 C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
26.对于平衡体系mA(g)+nB(g)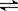 pC(g)+qD(g);△H<0。下列结论中不正确的是( )
pC(g)+qD(g);△H<0。下列结论中不正确的是( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.52倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m︰n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
25.下列叙述正确的是( )
A.原子晶体中可能存在极性共价键
B.干冰升华时分子内共价键发生断裂
C.原子晶体的熔点一定比离子晶体的熔点高
D.离子晶体中只含离子键,不含共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com