
题目列表(包括答案和解析)
3、 溶液稀释或混合的计算:
(1)可根据稀释前后,溶液中溶质的物质的量不变的公式,c1V1=c2V2或溶质的质量不变的公式,V1·ρ1·w1= V2·ρ2·w2= V1·c1·M= V2·c2·M计算有关的量。
(2)同种溶质(或含同种离子)的溶液混合,可根据混合前后溶质(或离子)的物质的量之和不变列式计算。稀释(或混合)前的溶液与水(或另一浓度的溶液)的质量可以相加。但是,体积一般不可以相加,而应运用m(后)/ρ(后)算出。只有稀释(或相互混合)且题中未给出稀释(或混合)后溶液的密度或密度变化较小时,才可忽略稀释(或混合)后的体积变化,将二者体积直接相加。
2、 溶液中溶质的质量分数与物质的量浓度之间的换算,溶液的密度是必不可少的条件。将质量分数换算成物质的量浓度时,可运用n=V·ρ·w/M算出1000mL溶液中所含溶质的物质的量。将物质的量浓度换算成质量分数时,可从1L溶液出发,运用
w=  直接计算。
直接计算。
1、 关于物质的量浓度的计算主要包括:
(1) 溶质的质量、溶液的体积和物质的量浓度之间的计算。可运用公式:n=m/M,c=n/V或运用“倍数关系”算出1L溶液所含溶质的物质的量。
(2) 已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的密度,计算溶液中的溶质的物质的量浓度。应先运用n=V/22.4L/mol,求出溶质的物质的量,运用V=m/ρ(液) 求出溶液的体积.
(3) 计算溶液中的离子浓度,还要根据溶质的电离方程式,算出离子的物质的量。
4. 物质的量浓度溶液的配制
(1) 计算:所需固体的质量或浓溶液的体积(小数点后保留一位小数)。
(2) 称:用天平。注意NaOH 等易潮解和腐蚀性的物质要放在小烧杯中迅速称量。
量:用量筒或滴管,注意规格。
(3) 溶解:在烧杯中进行。注意烧杯规格与所配溶液体积相近,加水量为所配溶液体积的一半。
(4) 移液:在冷却后进行,注意容量瓶规格。
(5) 洗涤:洗涤烧杯、玻璃棒2~3次,一起注入容量瓶中,并轻轻摇动容量瓶,再加水至近刻度1~2cm处。
(6)
 定容:注意定容后摇匀(此时液面有可能低于刻度线,那是在瓶塞处损耗之故,无需再定容)。
定容:注意定容后摇匀(此时液面有可能低于刻度线,那是在瓶塞处损耗之故,无需再定容)。
巧思巧解
3. 气体相对分子质量的计算
(1) 已知标准状况下气体密度ρ,M=22.4ρ
(2) 已知气体A对气体B的相对密度d,MA=dMB
(3)
已知混合气体的平均相对分子质量为 ,
, =m总/n总
=m总/n总
(式中m总是气体混合物的总质量,n总是混合气体的总物质的量)
(4) =M1w1+M2w2+……
=M1w1+M2w2+……
如M(空气)=28×78%+32×21%+40×0.94%+44×0.03%+18×0.03%=28.96
2. 阿伏加德罗定律及推论
|
条件 |
结论 |
文字 |
|
T、P相同 |
 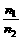 = = |
同温同压下,气体的分子数与其体积成正比 |
|
T、V相同 |
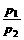 = =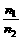 |
温度、体积相同的气体,压强与其分子数成正比 |
|
T、P相同 |
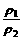 = = |
同温同压下,气体的密度与其相对分子质量成正比 |
|
T、P、V相同 |
 = = |
同温同压下,体积相同的气体,相对分子质量与其质量成正比 |
|
T、P、m相同 |
 = =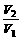 |
同温同压下,等质量的气体相对分子质量与其体积成反比 |
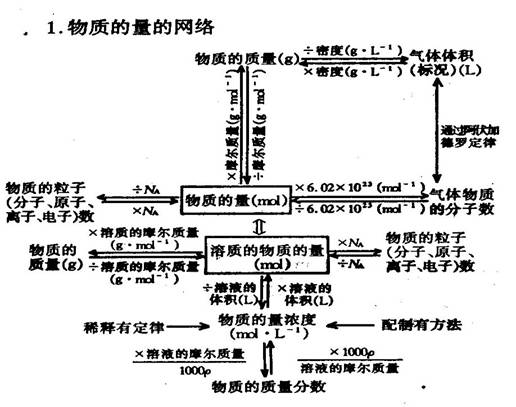
1. 物质的量的网络
12. (6分)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O 6Cu+SO2↑,请填写下列空白:
(6分)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O 6Cu+SO2↑,请填写下列空白:
⑴在该反应中,氧化剂是 。
⑵还原剂是 。
⑶氧化产物与还原产物的质量比 。
11.写出符合下列条件的化学方程式(各举一例)
⑴一种单质还原一种化合物
⑵一种单质氧化另一种单质
⑶一种化合物氧化另一种化合物
⑷一种非金属单质还原一种氧化物
10.(2分)初中化学学习时,课堂上做了一个用霍夫曼电解器电解水的演示实验,与电源负极连接一端产生氢气,发生了 (氧化、还原)反应;与电源正极连接的一端产生氧气,发生 (氧化、还原)反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com