
题目列表(包括答案和解析)
5. 下列各化合物的命名中正确的是
A.CH2=CH-CH=CH2 1,3-二丁烯
 B.
B.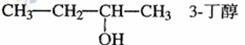
C.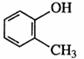 甲基苯酚
甲基苯酚
 D.
D. 2-甲基丁烷
2-甲基丁烷
4.香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A.常温下,1mol丁香酚只能与1molBr2反应
B.丁香酚不能使FeCl3溶液发生显色反应
C.1mol香兰素最多能与3mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
3.三聚氰胺为纯白色晶体,无味,溶于热水,微溶于冷水。结构简式如下图:
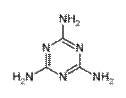 请根据已知材料结构式,下列选择不正确的是:
请根据已知材料结构式,下列选择不正确的是:
A. 三聚氰胺 分子式C3N6H6,相对分子质量126 B. 已知合成三聚氰胺的反应是:
6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2,反应物是尿素。
C.三聚氰胺分子所有原子在一个平面上
D.三聚氰胺呈弱碱性,与盐酸、硫酸、硝酸、乙酸、草酸等都能形成三聚氰胺盐
2.下列各组物质中,一定既不是同系物,又不是同分异构体的是
A.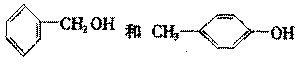
B.乙酸和硬脂酸
C.CH2O2和C3H6O2
D.苯甲酸和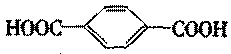
1.
2008年9月,“神舟”七号载人航天飞船,不但又一次实现多人多天太空航行,而且中国航天员成功完成首次太空行走并成功安全着陆。航天飞船是用“长征”二号F运载火箭(CZ-2F)发射的。火箭使用偏二甲肼(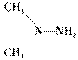 )和四氧化二氮作为推进剂,发生反应后生成N2、CO2和H2O。该反应配平后N2的化学计算数为
)和四氧化二氮作为推进剂,发生反应后生成N2、CO2和H2O。该反应配平后N2的化学计算数为
A.1 B.2 C.3 D.4
4. 氯乙烯是合成聚氯乙烯(PVC)的单体。乙烯氧氯化法是生产氯乙烯的主要方法。分三步进行(如图所示)
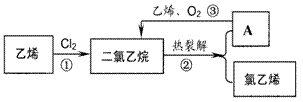
(l)下列关于乙烯、氯乙烯和聚氯乙烯的说法中,正确的是____ (填字母)。
A.都能在氧气中燃烧 B.都能发生加成反应使溴水退色
 C.都能使酸性高锰酸钾溶液退色D.氯乙烯分子中所有原子处于同一平面
C.都能使酸性高锰酸钾溶液退色D.氯乙烯分子中所有原子处于同一平面
(2)从环境保护的角度分析,氧氯化法的优点是______
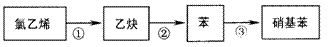
(3)某学生设计了下列反应:
 请写出③的化学方程式
请写出③的化学方程式
(4)己知二氯乙烷与Na0日溶液共热可生成乙二醇(HO-CH2CH2- OH ),请写出乙二醇与乙酸发生完全酷化反应的化学方程式_______________
(5)焚烧是废旧塑料的处理方法之一,但在焚烧过程中会排放出有毒物质。试写出聚氯乙 烯(PVC)塑料完全燃烧的化学方程式___________
3.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾
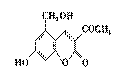
功能衰竭。“亮菌甲素”的结构简式为 ,它配以辅料丙二醇溶成
针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振仪可以测定有机物分子中处于不同化学环境的氢原子及相对数量。氢原子在分子中的化学环境不同,在核磁谱图中就处于不同的位置,化学环境相同的氢原子越多,波谱峰积分面积越大(或高度越高)。核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式
。
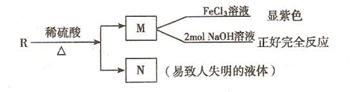
2.已知:HCN的结构为H-C≡N;
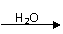
①R-CN RCOOH,
 ②R-Cl+CN- R-CN+Cl-(R为烃基)。
②R-Cl+CN- R-CN+Cl-(R为烃基)。
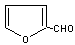 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:

⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
 写出能证明糠醛中含有醛基的一个化学反应方程式
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
 ⑷若E为高聚物,则其结构简式
。
⑷若E为高聚物,则其结构简式
。
1.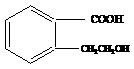 为有机物A的结构简式,可以通过不同的反应制得下列物质。
为有机物A的结构简式,可以通过不同的反应制得下列物质。
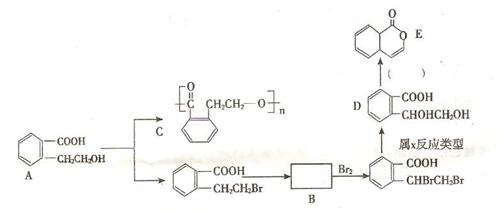
(1) 写出A → C的化学方程式: 。
(2) 推断B物质的结构简式 ;X反应类型是 ;由 D → E 所需的试剂是 。
(3) R物质属于A 的同分异构体,其性质如下:
试写出符合条件的R的同分异构体的结构简式(任写两种) : ; 。
4、 HCl、NH3 等气体经喷泉实验所得溶液浓度的无数据巧算方法:令气体体积(标准状况)为1L(不论是否充满烧瓶),喷泉后溶液体积亦为1L,故C为恒值:1/22.4mol/L≈0.045mol/L;但w则不为恒值,可根据气体摩尔质量、溶液密度(视为1g/mL)求算。
HCl、NH3 等气体经喷泉实验所得溶液浓度的无数据巧算方法:令气体体积(标准状况)为1L(不论是否充满烧瓶),喷泉后溶液体积亦为1L,故C为恒值:1/22.4mol/L≈0.045mol/L;但w则不为恒值,可根据气体摩尔质量、溶液密度(视为1g/mL)求算。
例题精析
[例1]设NA为阿伏加德罗常数,下列关于 0.2mol/L的Ba(NO3)2 溶液正确的说法是( )
A 2L溶液中有阴、阳离子总数为0.8NA
B 500mL溶液中NO3_离子浓度为0.2mol/L
C 500mL溶液中Ba2+离子浓度为0.2mol/L
D 500mL溶液中含NO3― 离子总数为0.4NA
[例2]在标准状况下,1体积水溶解700体积NH3 ,所得溶液密度为0.9g/cm3,则此氨水的物质的量浓度为 ( )
A 18.4mol/L B 34.7% C 20.4mol/L D 31.2%
★虽然氨水中的主要溶质是NH3·H2O,但有关质量分数及浓度计算均以NH3计算。
[例3]将14%的KOH溶液加热蒸发掉100g水后,变成80mL28%的KOH溶液,则此时溶液的物质的量浓度为( )
A 6mol/L B 6.25mol/L C 3.5mol/L D 7mol/L
建议:近年的高考化学中计算题的失分主要是在计算,建议计算过程中一律在小数点后保留一位小数(除非题中有有效数字取舍的强调或暗示),平时少用计算器。
[例4]标准状况下,用一定量的水吸收氨气后制得浓度为12mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水(水的密度以1.00g/cm3)?
[备选例题]超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3 +N2
+3C 2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
a) 称取10.00g样品,将其加入过量的NaOH 浓溶液中共热并蒸干,AlN跟NaOH 溶液反应生成NaAlO2 ,并放出氨气3.36L(标准状况).
① 上述反应的化学方程式为______________________________________________.
② 该样品中的AlN的质量分数为____________________
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应)。该样品中杂质炭 g。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com