
题目列表(包括答案和解析)
10.下列实验操作正确的是 ( )
A 称取NaOH固体,应在右盘加砝码,左盘纸上放NaOH固体
B 给试管内液体加热,应先均匀受热,后小心加热液体中下部
C 使用试纸要先放在表面皿或玻璃片上,用玻璃棒蘸溶液点在试纸中部,检验溶液性质
D 取淀粉水解液用NaOH中和至碱性,加入新制Cu(OH)2 悬浊液,水浴加热,无红色沉淀,证明淀粉没水
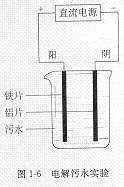
2.电浮选凝聚法是工业上采用的一种污水处理方法。
图1-6是电解污水实验装置示意图。接通直流电源后,与直流
电源正极相连的阳极铁失去电子生成Fe2+,进一步被氧化,并
生成Fe(OH)3沉淀,Fe(OH)3有吸附性,可吸附污物而沉积下来,
具有净化的作用;与直流电源负极相连的阴极产生H2,气泡把
污水中悬浮物带到水面形成浮渣层,积累到一定厚度时刮去(或
撇掉)浮渣层,即起到了浮选净化的作用。
1
 根据该净化原理写出阳极区和阴极区上各自发生的电极反
根据该净化原理写出阳极区和阴极区上各自发生的电极反
应式
阳极:
阴极:
(2)试分析不能参加反应的污染物是如何沉淀的:
(3)最后悬浮物为什么会形成浮渣:
(4)某同学甲模拟该原理进行污水处理实验,在电压符合要求情况下,发现产生气泡速率缓慢,无法使悬浮物形成浮渣。其原因是 。乙同学为甲同学提出一种切实可行的解决措施是向污水中加入适量的 溶液。
1. 绿色化学又称环境友好化学或清洁化学,是从源头上防止污染产生或把化学过程对环境的负面影响降低到最低程度的化学。绿色化学要求原料和产品无害,使化学过程不产生“三废”或使“三废”降低到最低程度。这些原则不仅适用于化工生产,同样是化学实验与日生活使用化学品时所应遵循的原则。
绿色化学又称环境友好化学或清洁化学,是从源头上防止污染产生或把化学过程对环境的负面影响降低到最低程度的化学。绿色化学要求原料和产品无害,使化学过程不产生“三废”或使“三废”降低到最低程度。这些原则不仅适用于化工生产,同样是化学实验与日生活使用化学品时所应遵循的原则。
化学实验的绿色化就是以绿色化学的理念和原则来指导实验工作,使实验室的“三废”排放降低到最低程度并能得到妥善的处理,实验室的安全性和环境质量得到提升,师生的绿色化学和环保意识得到强化。
下列实验或叙述符合绿色理念的是:
A.实验室用H2O2代替KClO3制取O2
B.用盐酸溶液吸收NH3尾气
C.用NaOH吸收CO2尾气
D.用KClO3代替MnO2在盖有表面皿的点滴板上制取Cl2并做Cl2与、KBr、KI、FeSO4、NaOH等溶液的实验
E.用如图装置利用倒吸原理清洗制取NO2后的实验装置
F.制CuSO4时先将Cu氧化成CuO后再与H2SO4(稀)反应
G.用稀HNO3代替浓HNO3与Cu反应制取Cu(NO3)2
H.实验后的废酸液、废碱液等定点回收
I.除去酸性工业废水中含有的Fe3+、Cd2+、Cr3+、Mn2+等离子时用废碱液或石灰石
J.除去含有Cu2+、Al3+、Fe3+的溶液中的Al3+、Fe3+时,加入CuO而不加入NaOH溶液
K.自来水公司为了降低暂时硬水的硬度[含Mg(HCO3)2、Ca(HCO3)2]时采用加热的方法
L.电镀工业使用无氰技术电镀锌等
M.将炼铁的炉渣用于制水泥
N.用纸质饭盒代替聚氯乙烯饭盒
O.用合成洗涤剂代替肥皂来洗涤衣物
P.用乙醇代替汽油作汽车燃料
 Q.工业上用H2O2代替NaClO3作氧化剂氧化Fe2+
Q.工业上用H2O2代替NaClO3作氧化剂氧化Fe2+
15. 25℃时,有0.01 mol•L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又生变化? 电离常数是否发生变化? 为什么 ?
14. 有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________。
13. 下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O,________________是强电解质;______________是弱电解质。
12. 已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2
NaNO2+HF==HCN+NaF NaNO2+HF==HNO2+NaF
由此可判断下列叙述中正确的是( )
A. HF的电离常数是① B. HNO2的电离常数是①
C. HCN的电离常数是② D. HNO2的电离常数是③
11. 把0.05 mol NaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是( )
A. 自来水 B. 0.5 mol•L-1盐酸
C. 0.5mol•L-1醋酸 D. 0.5 mol•L-1氯化铵溶液
10. 下列离子方程式错误的是( )
A. NaHS溶于水: NaHS==Na++HS- HS-+H2O  H3O++S2-
H3O++S2-
B. Al(OH)3电离: H2O+AlO2-+H+==Al(OH)3==Al3++3OH-
 C. (NH4)2SO4溶于水:(NH4)2SO4
C. (NH4)2SO4溶于水:(NH4)2SO4 2NH4++SO42-
2NH4++SO42-
D. HF溶于水:HF+H2O H3O++F-
H3O++F-
9. 已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 升高温度 C. 加少量冰醋酸 D. 加水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com