
题目列表(包括答案和解析)
4. 0.1mol/L的CH3COONa溶液和0.1mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
A.c(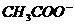 )>c(CH3COOH)
)>c(CH3COOH)
B.c( )+c(
)+c(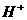 )=c(
)=c(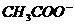 )+c(
)+c( )
)
C.c(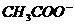 )+c(
)+c( )>c(
)>c( )
)
D.c( )+c(CH3COOH)=c(
)+c(CH3COOH)=c( )
)
3. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
2. 将0.1mol/L醋酸溶液加水稀释,下列说法正确的是
A. 溶液中c(H+)和c(OH-)都减小
B. 溶液中c(H+)增大
C. 醋酸电离平衡向左移动
D. 溶液的PH增大
1. 一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A. NaOH(固体) B. H2O C.HCl D.CH3COONa(固体)
1. (2008广东高考)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e - =Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②
B.②③
C.②④
D.③④
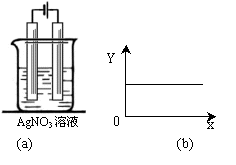
2.(2008泉州模拟)按图a中装置进行实验,若图b的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是
A.c(Ag+)
B.c(NO3-)
C.溶液的pH D.银棒质量
(2008广东高考)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e - =Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②
B.②③
C.②④
D.③④
2.(2008泉州模拟)按图a中装置进行实验,若图b的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是
A.c(Ag+)
B.c(NO3-)
C.溶液的pH D.银棒质量
 3.(2007广东高考)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
5.(2007如皋调研)一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2
3.(2007广东高考)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
5.(2007如皋调研)一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+
6.(2006湖北一联)下列能够使反应:Cu+2H2O=Cu(OH)2+H2↑
获得成功的是:
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜--锌合金在潮湿的空气中发生电化学腐蚀
O3+3H2O2。下列有关说法正确的是
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+
6.(2006湖北一联)下列能够使反应:Cu+2H2O=Cu(OH)2+H2↑
获得成功的是:
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜--锌合金在潮湿的空气中发生电化学腐蚀
 C.用铜片作阴、阳电极,电解氯化钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
7.(2006绵阳一诊)如下图装置中,b电极用金属.M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
C.用铜片作阴、阳电极,电解氯化钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
7.(2006绵阳一诊)如下图装置中,b电极用金属.M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
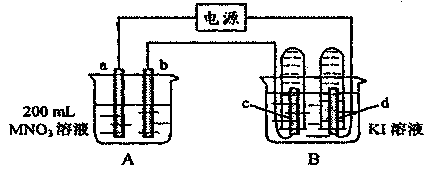 (1)a为
极,c极的电极反应式为
。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 .
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了
moL气体,若b电极上沉积金属M的质量为0.432g,,则此金属的摩尔质量为 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到 25.0mL0.100mol·L-1HCI溶液中,当加入31.25mL溶液时刚好沉淀完全。试计算:电解前A烧杯中MNO3溶液的物质的量浓度。
8. 已知C、D、F、I均为常见气体,E为常见金属,G溶液蒸干并灼热得红棕色粉末H,I是一种能导致温室效应的气体,B由三种元素组成三它们有如下框图关系:
(1)a为
极,c极的电极反应式为
。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 .
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了
moL气体,若b电极上沉积金属M的质量为0.432g,,则此金属的摩尔质量为 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到 25.0mL0.100mol·L-1HCI溶液中,当加入31.25mL溶液时刚好沉淀完全。试计算:电解前A烧杯中MNO3溶液的物质的量浓度。
8. 已知C、D、F、I均为常见气体,E为常见金属,G溶液蒸干并灼热得红棕色粉末H,I是一种能导致温室效应的气体,B由三种元素组成三它们有如下框图关系:
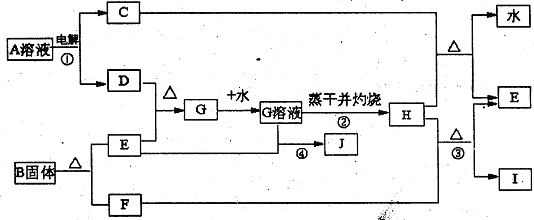 试回答下列问题
(1)反应①阳极的电极反应式
。
(2)反应③的化学方程式
。
(3)反应④的审子方程式
。
(4)反应②蒸发至于并灼烧最终得H而不是无水的G,试用文字和方程式简述其理由:
。
(5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,写出B的化学式
。
试回答下列问题
(1)反应①阳极的电极反应式
。
(2)反应③的化学方程式
。
(3)反应④的审子方程式
。
(4)反应②蒸发至于并灼烧最终得H而不是无水的G,试用文字和方程式简述其理由:
。
(5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,写出B的化学式
。
8. 在25℃时将pH=11 的NaOH
溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是
在25℃时将pH=11 的NaOH
溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.c (Na+)=c(CH3COO-)+c(CH3COOH) B.c(H+)=c(CH3COO-)+c(OH一)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
7.常温下,下列酸碱发生中和反应,有关判断正确的是
A.同浓度的NaOH溶液和CH3COOH溶液等体积混合后,
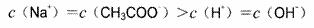
B.pH=3的CH3COOH溶液和pH=11的KOH溶液等体积混合,
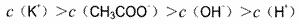
C.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合,
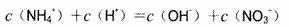
D.pH=2的盐酸与pH=11的NaOH溶液按体积比2:9混合,混合液pH=3.2
6. MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是( )
A.MOH和ROH都是强碱
B.稀释前,c(ROH)=10c(MOH)
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,c(M+)=c(R+)
5.在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是( )
A.Ca2+、AlO2-、SO42-、Cl- B.K+、Na+、ClO-、Cl-
C.Na+、Fe2+、NO3-、SO42- D.NH4+、Na+、F-、CO32-
4. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是 ( )
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)> c(OH-)>c(H+) 
D.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com