
题目列表(包括答案和解析)
2.下列内容在容量瓶上无需标出的是 ( )
A.刻度线 B.容量标准
C. 温度 D.配制溶液的浓度
1.同温同压下,同体积的气体单质X2和气体单质Y2化合生成Z,其体积不变,则Z的化学式为 ( )
A. X2Y2 B. X2Y
C. XY2 D. XY
31.(7分)主族元素R的最高价氧化物0.112g,溶于水制得100g碱性溶液,其溶质的质量分数为0.148%,R原子核内含有20个中子。试通过计算,确定R元素在周期中的位置。


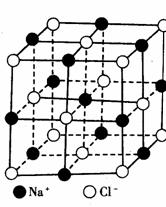 32.(12分)晶胞是晶体中最小重复单位,并在空间不断
32.(12分)晶胞是晶体中最小重复单位,并在空间不断
伸展构成晶体。NaCl晶体是一个正六面体(如图)。
我们把阴、阳离子看成不等径的圆球,并彼此相
切,离子键的键长是相邻阴阳离子的半径之和(如
图)。已知a为常数,请计算下列问题:
(1)每个晶胞中平均分摊____个Na+,____个C1-。
(2)若某NaCl晶体的质量为5.85克,它约含____
____摩尔NaCl晶胞。
⑶NaCl晶体离子键的键长为_______,Na+离子
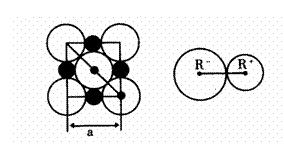
 半径与Cl-离子半径之比为
半径与Cl-离子半径之比为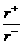 =_________。
=_________。
(4)NaCl晶体不存在分子,但在高温下(≥1413℃时)晶体转变成气体NaCl的分子形式存在,现有1mol NaCl晶体,加强热使其气化,测得气体体积为11.2升(已折为标况)。则此时氯化钠气体的分子式为____________。
30.(12分)A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A________,D_________,E________。
(2)B的单质在F的单质中的现象是_________,化学方程式是___________________
____________________________________________________________________________。
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式是__________________
___________________________________________________________________________。
29.(8分)第88号元素镭(Ra)在元素周期表的第七周期第ⅡA族。
(1)试比较氢氧化镭与消石灰的碱性强弱。________________________________。
(2)写出氯化镭、硫酸镭、碳酸镭的化学式。试推断这三种盐在水中的溶解性(易溶或难溶)。_____________________、____________________、____________________。
28. (12分)如图所示,甲、乙、丙是三种常见的单质,X、Y、Z是三种常见的化合物。
(12分)如图所示,甲、乙、丙是三种常见的单质,X、Y、Z是三种常见的化合物。
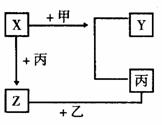 若甲是具有还原性的单质,X、Y、Z
若甲是具有还原性的单质,X、Y、Z
三种化合物有一种为离子晶体:
(1)XYZ中含有丙元素的是________。
(2)X与甲反应的化学方程式________。
(3)Z的化学式________;X的电子式____________。
(4)Y的化学式________;Y的电子式____________。
27. (8分)有A、B、C、D四种元素,A的最高价与其负价的绝对值之差为6;A、D次外层都是8个电子,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴阳离子,B有2个电子层,其最高正价与最低负价的代数和为零,C2-离子与氦原子具有相同的电子层结构。试写出上述元素的符号A___________,B___________,C__________,D__________。
26. (7分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
|
|
B |
|
|
A |
X |
C |
|
|
D |
|
(1)各元素的符号:
A:_____,B:____,C:____,D:_____,X:_____。
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:__________________。

25. (12分)在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是______。
(2)以极性键相结合,具有直线型结构的非极性分子是_____。
(3)以极性键相结合,具有正四面体结构的非极性分子是_____。
(4)以极性键相结合,具有三角锥型结构的极性分子是_____。
(5)以极性键相结合,具有折线型结构的极性分子是______。
(6)以极性键相结合,而且分子极性最大的是______。
24.已知X、Y、Z、T四种非金属元素,X、Y在反应时各结合一个电子形成稳定结构所放出的能量是Y>X; 氢化物稳定性是HX>HT; 原子序数T>Z, 其稳定结构的离子核外电子数相等,而其离子半径是Z>T。四种元素的非金属性从强到弱排列顺序正确的是 ( )
A. X、Y、Z、T B. Y、X、Z、T
C. X、Y、T、Z D. Y、X、T、Z
第Ⅱ卷 (非选择题 共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com