
题目列表(包括答案和解析)
7.反应:A(g)+3B(g) 2C(g)
2C(g) <0达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
( )
<0达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
( )
A.正反应速率加大,逆反应速率变小,平衡向逆反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
6.对反应2SO2+O2 2SO3,下列变化可增大活化分子百分数而使反应速率加快的是:
2SO3,下列变化可增大活化分子百分数而使反应速率加快的是:
①增大压强 ②升高温度 ③增大O2的浓度 ④使用催化剂 ( )
A.①③ B.①④ C.②③ D.②④
5.在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间
2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间
内用H2表示的平均反应速率为0.45mol/(L·s),则所经历的反应时间是 ( )
A.0.2s B.1s C.2s D.1.2s
4.在容积固定为2L的密闭容器中,充入X、Y气体各2mol,
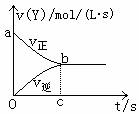 发生可逆反应:X(g)+2Y(g)
发生可逆反应:X(g)+2Y(g) 2Z(g),并达到平衡,
2Z(g),并达到平衡,
以Y的浓度改变表示的反应速率v正、v逆与时间t的关系
如右图所示,则Y的平衡浓度表达式正确的是(式中S是
表示对应区域的面积) ( )
A.2 – Saob B.1 – Saob
C.2 – Sabco D.1 – Sboc
3.在四个不同的容器中,在不同的条件下进行合成氨的反应。根据下列在相同时间内测定
的结果判断生成氨气的速率最大的是 ( )
A.v(H2)=0.1mol·L-1·min-1 B.v(N2)=0.1mol·L-1·min-1
C.v(N2)=0.2mol·L-1·min-1 D.v(NH3)=0.3mol·L-1·min-1
2.下列关于化学反应速率的说法正确的是 ( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
1.反应4A(s)+3B(g) 2C(g)+D(g)经2 min,B的浓度减少0.6mol/L,对此反应速率的表示正确的是
( )
2C(g)+D(g)经2 min,B的浓度减少0.6mol/L,对此反应速率的表示正确的是
( )
A.用A表示的反应速率是0.4mol/(L·min)
B.分别用B、C、D表示的反应速率,其比值是1:2:3
C.在2 min末时的反应速率,用反应物B来表示是0.3mol/(L·min)
D.在这2 min内用B和C表示反应的速率的值都是逐渐减小的
26. (5分)锈铁片(铁锈为氧化铁)置于稀硝酸中,反应结束后收集到1.12LNO
(5分)锈铁片(铁锈为氧化铁)置于稀硝酸中,反应结束后收集到1.12LNO
(标准状况),溶液中还剩下4g单质铁。取出铁后,向溶液中通入10.65gCl2,
恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+反应)。计算:
(1)锈铁片中铁单质的质量。
(2)锈铁片中铁锈的质量分数。
宜昌市“三校联合体”2008-2009学年度第一学期
25.(10分)Ⅰ、在25mL氢氧化钠溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如右图所示,
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 。
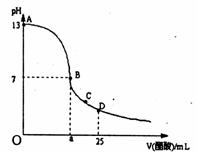 (2)该氢氧化钠溶液的物质的量浓度为 mol·L-1
(2)该氢氧化钠溶液的物质的量浓度为 mol·L-1
(3)在B点,a 12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH)___ _____ c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:
c(H+)___c(OH-)。
(4)在D点溶液中离子浓度大小关系为 。
Ⅱ、现有常温下的0.1mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示): 。
为证明你的上述观点,请设计一个简单的实验,简述实验过程: 。
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正
确的是 。
a+)=2c(CO32-) B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1mol·L-1 D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
24.(8分)(1)氢氧燃料电池若以金属铂(Pt)电极材料,电解质溶液是KOH溶液,则负极应通入 ,正极通入 , 电极反应分别为:正极 ,负极 。
(2)如果把氢气改为甲烷,KOH溶液作电解质溶液,则电极反应分别为:
正极 ,负极 。电池反应方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com