
题目列表(包括答案和解析)
18.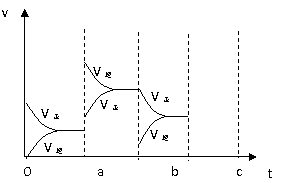 (12分)Ⅰ.下图是表示在密闭容器中反应:2SO2+O2
(12分)Ⅰ.下图是表示在密闭容器中反应:2SO2+O2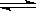 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b
c过程中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c~d处。
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b
c过程中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c~d处。
Ⅱ.在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:
2A(g)+B(g)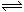 3C(g)+D(g)达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度
3C(g)+D(g)达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度
(填“大于”“小于”或“等于”)。
(1)加入2mol A、1mol B、3mol C、1mol D时,C的平衡浓度________Wmol·L-1。
(2)加入3 mol C和1 mol D时,C的平衡浓度_________Wmol·L-1。
(3)加入2 mol B、3 mol C、1 mol D时,C的平衡浓度_________Wmol·L-1。
17.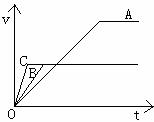 (6分)右图中A、B、C三条曲线分别表示足量的Na2CO3和
(6分)右图中A、B、C三条曲线分别表示足量的Na2CO3和
①100mL 2 mol/L盐酸②200mL 1 mol/L盐酸③400mL 0.8mol/L
盐酸反应时,反应时间t与产生CO2体积V的关系。由图可
以判断:A是Na2CO3和 盐酸的反应;B是Na2CO3和
盐酸的反应;C是Na2CO3和 盐酸的反应。(填
盐酸的序号)
16.(8分)“碘钟”实验中,3I-+S2O82--=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃、1个大气压条件下进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1= 。
(3)若在2个大气压下进行编号③对应浓度的实验,显色时间t2的范围为 (填序号)
A.<22.0s B.22.0s~44.0s C.>44.0s D.22.0s
(4)通过分析比较表中的数据,所得到的结论是 。
15.可逆反应:3A(g)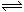 3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
( )
3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C不可能都是气体
第Ⅱ卷(55分)
|
14.恒温恒容条件下,下列叙述正确的是 ( )
A.相同的甲、乙两容器中分别加入1gSO2、1gO2与2gSO2、2gO2,
发生反应2SO2(g)+O2(g)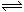 2SO3(g)达到平衡,SO2的转化率前者大
2SO3(g)达到平衡,SO2的转化率前者大
B.反应2HI(g)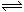 H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
C.反应2HI(g)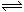 H2(g)+I2(g)达到平衡,增大HI的物质的量,HI分解率和体
H2(g)+I2(g)达到平衡,增大HI的物质的量,HI分解率和体
积分数不变
D.反应2NO2(g) N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重
新达到平衡时,与第一次平衡时相比,NO2的体积分数增大。
13.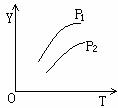 如下图所示,不同温度和压强下,在容积不变的密闭容器中对可逆反应:4L(g)
如下图所示,不同温度和压强下,在容积不变的密闭容器中对可逆反应:4L(g) 2M(g)+N(g) △H>0平衡状态的影响(P1>P2),图中Y轴是指 ( )
2M(g)+N(g) △H>0平衡状态的影响(P1>P2),图中Y轴是指 ( )
A.气体混合物的平均相对分子质量
B.气体混合物的总物质的量浓度
C.L在气体混合物中的体积分数
D.气体混合物的密度
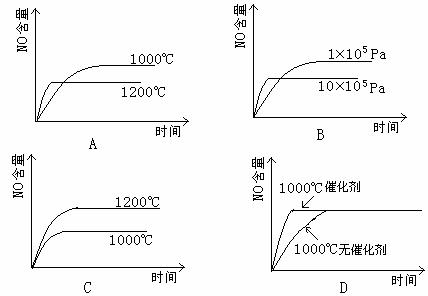
12.已知:4NH3(g)+5O2(g) 4NO(g)+6H2(g);△H=-1025KJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
( )
4NO(g)+6H2(g);△H=-1025KJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
( )
11.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)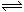 C(g)+D(g)已经达到平衡状态:①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体总质量
⑧混合气体总体积 ( )
C(g)+D(g)已经达到平衡状态:①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体总质量
⑧混合气体总体积 ( )
A.①②③④⑤⑥⑦⑧ B.①③④⑤
C.①②③④⑤⑦ D.①③④⑤⑧
9.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g);
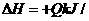 mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L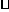 min)
min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/LNaOH溶液恰好反
应
|
A.判断反应的方向 B.确定反应是否一定发生
C.判断反应过程发生的速率 D.判断反应过程的热效率
8.高温下,某反应达平衡,平衡常数K= , 恒容时,温度升高,H2 浓度减
小。下列说法正确的是 ( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强, H2 浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为 CO
+ H2O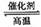 CO2
+ H2
CO2
+ H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com