
题目列表(包括答案和解析)
5.在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol / L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
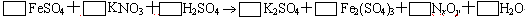
(1) 推算出x= _________,y= _________
(2) 配平该化学方程式(化学计量数填写在上式方框内)
4. 要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水
②加入足量KMnO4溶液
③加入少量NH4SCN溶液
A. ①③ B.③② C.③① D.①②③
3. m g铁屑与含有n g死翱算的硝酸溶液恰好完全反应,若m:n=1:3,则起氧化剂作用的硝酸的质量是多少克
A. m B. 3/4 m C. 1/2 n D.1/4 n
2. 今有浓度均为3mol·L-1的盐酸和硫酸各100mL,分别加入等质量的Fe粉,反应完毕后生成气体的质量之比为3:4,则加入盐酸中的铁粉的质量为
A. 5.6g B.8.4g C.11.2g D.16.8g
1. 下列各物质中,不能由组成它的两种元素的单质直接化合得到的是
A. FeS B. FeCl2 C. FeCl3 D.Fe3O4
32.(10分)为了测定某铜银合金的成分,将30.0 g该合金溶于80 mL13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液的c(H+)=1mol/L。假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的硝酸的物质的量。
31.(9分)某硫酸厂每天用含FeS260%的硫铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%。每天能生产98%的硫酸多少吨?
30.(10分)酸雨是由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4和HNO3(主要是H2SO4)随雨水降落而形成的。为防止污染,硫酸厂用氨水来吸收二氧化硫,离子方程式为_____________________________________;硝酸厂可用烧碱溶液来吸收氮的氧化物,如NO2被烧碱吸收生成NaNO2和NaNO3,离子方程式为_____________________________;也可用氨的催化还原法把氮的氧化物变成氮气,还原1体积NOx需要________体积氨气。对酸雨地区的治理,目前一种比较有效的方法是用直升飞机喷撒白垩粉,降解酸雨污染,其离子方程式是(分别写出与硫酸与硝酸的反应)_________________________________________
 ____________________________________________________________________________。
____________________________________________________________________________。

29.(10分)锗是ⅣA族元素,它的单质晶体是一种良好的半导体材料,被广泛地应用在电子工业上。锗可以从燃烧的烟道灰中提取,其过程可表示如下:
|



 烟道灰中所含锗 锗 的
锗
纯净的锗
烟道灰中所含锗 锗 的
锗
纯净的锗



 的氧化物(高价) 氯化物
酸
的氧化物
的氧化物(高价) 氯化物
酸
的氧化物
根据以上实验过程,写出各步反应的化学方程式:
①_______________________________________;
②_______________________________________;
③_______________________________________;
④_______________________________________。
28. (10分) 在盛有淀粉KI溶液(用H2SO4酸化)的试管中,滴加少量的次氯酸钠溶液,会立即看到溶液变在蓝色,这是因为___________________________________________________的缘故,相应的离子方程式为________________________________________________。在盛有淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色溶液逐渐消失,这是因为_______________________________________________________的缘故,相应的离子方程式为_________________________________________________________。对比上述两组实验所得结果,可得出ClO-、I2、SO42-的氧化性由强到弱的顺序为_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com