
题目列表(包括答案和解析)
3. 在2A+B
在2A+B 3C+4D反应中,表示反应速率最快的是( )
3C+4D反应中,表示反应速率最快的是( )
A.V(A)=0.5mol·L-1·S-1 B. V(B)=0.3mol·L-1·S-1
C. V(C)=0.8mol·L-1·S-1 D. V(D)=1mol·L-1·S-1
2. 2008年5月12日2点28分,在四川汶川发生7.8级地震,颤动亚洲,造成特大伤亡事故。救灾人员将对受灾地区用新一代广谱、高效、无污染的饮用水消毒剂ClO2(其中氯元素为+4价,消毒时被还原为-1价)杀菌。下列关于ClO2的说法不正确的是( )
2008年5月12日2点28分,在四川汶川发生7.8级地震,颤动亚洲,造成特大伤亡事故。救灾人员将对受灾地区用新一代广谱、高效、无污染的饮用水消毒剂ClO2(其中氯元素为+4价,消毒时被还原为-1价)杀菌。下列关于ClO2的说法不正确的是( )
A.ClO2可以作消毒剂,是因为它具有强氧化性
B.等质量的ClO2和Cl2,在相同的条件下ClO2的消毒效率高
C.为防止疾病的传播,在当地喷洒ClO2 的水溶液,可以加快杀菌消毒的速度。
D.将ClO2+Mn2++H2O MnO2↓+H++Cl-配平后,H2O的化学计量数为4
MnO2↓+H++Cl-配平后,H2O的化学计量数为4
1.下列过程中,需要加快化学反应速率的是( )
A.钢铁腐蚀 B.食物腐败 C.炼钢 D.塑料老化
2.化学平衡移动
(1)影响化学平衡移动的条件
①浓度:其他条件不变的情况下,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动,此时v(正)>v(逆);反之,如果减小反应物浓度或增大生成物浓度,可使化学平衡向逆反应方向移动,此时v(正)<v(逆)。
②压强:对有气体参加的可逆反应,反应前后体积发生变化时,若其他条件不变,加大压强会使平衡向气体体积缩小的方向移动,反之向气体体积扩大的方向移动。气体体积在反应前后保持不变的反应,则改变压强对平衡无影响。
③温度:其他条件不变时,升温使平衡向吸热反应方向移动;降温使平衡向放热反应方向移动。对于一个可逆反应,如果正反应放热,则逆反应一定吸热。
④催化剂对化学平衡无影响,但能缩短达到平衡所需时间。
(2)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bBc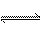 C(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了
C(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了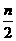 mol,C增加了
mol,C增加了 n mol,D增加了n mol,此时达到化学平衡。
n mol,D增加了n mol,此时达到化学平衡。
①该化学方程式各物质的化学计量数为a=2、b=1、c=3、=2;
②若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A 气态,B 固态(或液态),D气态。
③若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为放热(填“放热”或“吸热”)反应。
链接·拓展
研究化学反应速率时,不要考虑该反应是否为可逆反应,不可逆反应也有反应速率,但研究化学平衡或化学平衡移动时,就一定要考虑化学反应速率。

v(正)>v(逆) v(正)=v(逆) v(正)≠v(逆) v′(正)=v′(逆)
化学平衡移动,化学反应速率一定变化,并且由速率变化引起,但化学反应速率变化,平衡不一定移动,如加入催化剂等。
理解·要点诠释
考点1 化学平衡状态的判断
化学平衡状态的标志:v(正)=v(逆);平衡混合物中各组成成分的含量保持不变。“v(正)=v(逆)”是化学平衡的本质特征,其含义是反应体系中同一物质的消耗速率和生成速率相等。而各组分的含量“不变”,是指各组分的浓度、质量分数、体积分数(有气体参加的可逆反应)、反应物的转化率等均保持不变。“不变”不能理解为“相等”。
判断某一可逆反应是否达到平衡状态的标志:
(1)对于反应前后气体体积没有发生变化的可逆反应
如A2(g)+B2(g) 2AB(g)达到平衡状态时:
2AB(g)达到平衡状态时:
①外界条件不变时,A2、B2、AB的体积分数、物质的量分数、质量分数以及分子数之比均不变,A2、B2的转化率不变。(定)
②A2与B2生成AB的速率与AB分解的速率相等;单位时间内,A2、B2生成AB的分子数与AB分解的分子数相等。(v(正)=v(逆))
③温度一定时,体系温度不变;体系的颜色也不变。
(2)对于反应前后气体体积发生变化的可逆反应
如A(g)+3B(g) 2Z(g)达到平衡状态时,除上述三条标志外,还有:
2Z(g)达到平衡状态时,除上述三条标志外,还有:
外界条件不变时,体系平均相对分子质量、压强、总物质的量、密度等不变。
考点2 化学平衡移动与平衡移动原理
(1)化学平衡移动的分析方法

应用上述规律分析问题时应注意:
①不要把v(正)增大与平衡向正反应方向移动等同起来,只有v(正)>v(逆)时,才使平衡向正反应方向移动。
②不要把平衡向正反应方向移动与原料转化率的提高等同起来,当反应物总量不变时,平衡向正反应方向移动,反应物转化率提高,当增大一种反应物的浓度,使平衡向正反应方向移动时,会使另一种反应物的转化率提高。
(2)化学平衡移动原理
外界条件对化学平衡的影响可概括为一句话,即“勒夏特列原理”:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向着能够减弱这种改变的方向移动。
①原理中“减弱这种改变”的正确理解应当是:升高温度时,平衡向吸热反应方向移动;增加反应物,平衡向反应物减少的方向移动;增大压强时,平衡向体积缩小的方向移动。
②移动的结果只是减弱了外界条件的变化,而不能完全抵消外界条件的变化,新平衡时此物理量更靠近于改变的方向。如增大反应物A的浓度,平衡右移,但达到新平衡时,A的浓度比原平衡更大;同理,若改变的是温度、压强等,其变化也相似。
考点3 正确识别综合图象
改变外界条件对化学反应速率及化学平衡的影响,可用各种图象来表示,解答图象题目的方法思路是:
(1)看懂图象:一看面(即看清横坐标和纵坐标),二看线(即看线的走向、变化的趋势),三看点(即看线是否通过原点,两条线的交点及线的拐点),四看要不要作辅助线(如等温线、等压线),五看定量图象中有关量的多少。
(2)联想规律:即联想外界条件对化学反应速率和化学平衡的影响规律,且熟练准确。
(3)作出判断:认准某些关键数据在解题中的特定作用。全面、准确地从图中找出直接或隐含的相关化学知识。
难点 等效平衡的判断
化学平衡状态的建立与条件(如浓度、温度、压强)有关,与途径无关。建立平衡状态通常有4条途径:①正向建立;②逆向建立;③从中间某状态建立;④反应物分批加入。对不同的起始状态,通常假定反应沿某一方向进行到底,将所得物质的量与标准状态比较,规律如下:
(1)反应前后气体体积之和不等的可逆反应,如2SO2+O2 2SO3,恒温、恒容投料相同,或恒温、恒压投料成比例,即为等效平衡。
2SO3,恒温、恒容投料相同,或恒温、恒压投料成比例,即为等效平衡。
(2)反应前后气体体积之和相等的可逆反应,如2HI(g) I2(g)+H2(g),恒温、恒容,或恒温、恒压,两种情况均是投料成比例,即为等效平衡。
I2(g)+H2(g),恒温、恒容,或恒温、恒压,两种情况均是投料成比例,即为等效平衡。
诱思·实例点拨
[例1] (2005江苏高考理综,15)哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
解析:N2与H2合成氨的反应是可逆反应,N2不可能完全转化为NH3,A错;达到平衡时,N2、NH3、H2的物质的量浓度不再变化而不是一定相等,B错;达到平衡时,正、逆反应速率相等而反应仍在进行,故都不为零,D错。
答案:C
讲评:本题通过诺贝尔化学奖这一情景考查考生对化学平衡概念的理解掌握情况,注重考查考生的理解能力和分析判断能力。
[例2] (2005全国高考理综Ⅲ,8 )在体积可变的密闭容器中,反应mA(g)+nB(s) pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )
A.(m+n)必定小于p B.(m+n)必定大于p
C.m必定小于p D.m必定大于p
解析:对于反应mA(g)+nB(s) pC(g)达到平衡后,减小容器的体积,A的转化率降低,说明减小体积、增大压强,平衡向逆反应方向移动,根据勒夏特列原理,增大压强平衡向气体体积缩小的方向移动,因此方程式左边的气体体积比右边小,故m<p(从原理中得出B为固体,对平衡无影响,不用考虑)
pC(g)达到平衡后,减小容器的体积,A的转化率降低,说明减小体积、增大压强,平衡向逆反应方向移动,根据勒夏特列原理,增大压强平衡向气体体积缩小的方向移动,因此方程式左边的气体体积比右边小,故m<p(从原理中得出B为固体,对平衡无影响,不用考虑)
答案:C
讲评:本题考查了考生对勒夏特列原理的应用及一定的答题素质,考生要注意审题,看清楚A、C为气体,B为固体,再根据勒夏特列原理推出结论。
[例3] 对于可逆反应:A2(g)+3B2(g) 2AB3(g);ΔH<0,下列图象中正确的是( )
2AB3(g);ΔH<0,下列图象中正确的是( )
解析:该反应是放热反应,达到平衡后(v(正)=v(逆)),升高温度平衡向逆反应方向移动, v(正)与v(逆)都增大,但v(正)<v(逆),故A正确。增大压强平衡向正反应方向移动,AB3的物质的量分数(AB3%)增大,B2的物质的量分数(B2%)减小,故B、C均不正确。升高温度平衡向逆反应方向移动,A2和B2的物质的量分数都增大,故C、D均不正确。
答案:A
讲评:本题为化学平衡图象题,此类题目比较多,它能很好地考查学生的分析推理能力和综合能力。解答此类题目:一是要根据反应特点,看清横、纵坐标表示的意义,各曲线的变化趋势反映到化学上的意义,明确起点、折点、终点的意义;二是要结合图象题各自的特点,形成正确的分析方法思路,掌握解题技巧,从而快速准确地解决问题。
链接·提示
解答化学反应速率和化学平衡图象题的前提是:正确识别图象,明确曲线的“三点一走向”(起点、转折点、终点(转折点是特殊点--解题重要依据);走向为变化趋势)。
解题技巧是:(1)“先拐先平”:在含量时间曲线中,先出现拐点的则先达到平衡,说明该曲线表示的温度较高或压强较大。
(2)“定一议二”:在含量T或p曲线中,图象中有三个变量,先确定一个量不变,再讨论另外两个量的关系(因平衡移动原理只适用于“单因素”的改变)。即确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后(通常可画一垂线),讨论横坐标与曲线的关系。
1.化学平衡状态
(1)在一定条件下,将0.03 mol CO和0.02 mol H2O(g)通入2 L密闭容器中,进行反应:
CO+H2O(g) CO2+H2
CO2+H2
①反应刚开始时,反应物浓度最大,正反应速率最大;生成物浓度为0,逆反应速率为0。
②反应进行中,反应物浓度逐渐减小,正反应速率逐渐减小;生成物浓度逐渐增大,逆反应速率逐渐增大。
③达到平衡时,正反应速率与逆反应速率相等,此时反应物浓度不再发生变化,生成物浓度也不再发生变化。
④若达平衡时,水蒸气的体积分数与H2的体积分数相等,则平衡时一氧化碳的转化率为25%。
(2)在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是(AC)
2Z(g)达到平衡的标志是(AC)
A.Z的生成速率与Z的分解速率相等
B.单位时间生成a mol X,同时生成3a mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数之比为1∶3∶2
20.(12分)2005年12月2日新浪网报道,我国独立研制的具有自主知识产权的“龙芯2D”12月底完成流片。“龙芯2D”的面世,意味着中国在半导体产业上已取得了长足进步,同时将有着良好的发展前景。
试回答下列问题:
(1)“龙芯”(芯片)的主要成分是单晶硅,硅位于元素周期表中第____周期____族;
 (2)硅在一定条件下可以与氯气反应生成SiCl4,与氧气反应生成SiO2。四氯化硅结构中,所有原子最外层 (填“是、否”)都满足8电子稳定结构。用电子式表示四氯化硅的形成过程。
(2)硅在一定条件下可以与氯气反应生成SiCl4,与氧气反应生成SiO2。四氯化硅结构中,所有原子最外层 (填“是、否”)都满足8电子稳定结构。用电子式表示四氯化硅的形成过程。
(3)试判断SiCl4的沸点比CCl4的 (填“高或低”),理由
。若已知CCl4比SiCl4稳定,则C-Cl键的键能比Si-Cl键的键能 (填大、小)。
 (4)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质分子Si12,它可能在未来的量子计算机中是一个理想的贮存信息的材料,根据下图推断这种六角形笼状结构:它与单晶硅(参照右图)互称为
,硅原子之间是通过
键结合的。
(4)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质分子Si12,它可能在未来的量子计算机中是一个理想的贮存信息的材料,根据下图推断这种六角形笼状结构:它与单晶硅(参照右图)互称为
,硅原子之间是通过
键结合的。
 附加题:(检查以上答题,如果你觉得还不到60分,可以继续做此题,分数可以累加,如果已超过60分,分数不累加)
附加题:(检查以上答题,如果你觉得还不到60分,可以继续做此题,分数可以累加,如果已超过60分,分数不累加)
|
|
甲烷 |
氨分子 |
二氧化碳 |
|
分子空间构型 |
|
|
|
|
键角 |
|
|
|
|
分子的极性 |
|
|
|
19.(10分)在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z。已知:
①反应前的X与反应后生成的Z的物质的量之比
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是___________,单质Z是___________(填分子式)。
(2)1个Y分子中共含___________个共价键。键角是 。
(3)X分解为Y和Z的化学方程式为: 。
18.(13分)已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)写出元素符号:X ;Y ;Z ;W 。
(2)X单质和Z单质在一定条件下反应生成化合物E, E分子的空间构成型为 ,分子的极性为 。
(3)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),
该化合物的化学式为 ,它含有的化学键类型有_______键、_________ 键和_________键。
17.(12分)下表是元素周期表的一部分,表中字母分别代表某一化学元素。
 (1)a、e属于同一主族,可否组成化合物,
若能写出它的化学式__________,电子式
,其化学键的类型是
。
(1)a、e属于同一主族,可否组成化合物,
若能写出它的化学式__________,电子式
,其化学键的类型是
。
 (2)NH3·H2O的电离方程式为
NH3·H2O
(2)NH3·H2O的电离方程式为
NH3·H2O NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)

 (3)在一定体积的容器中,加入1.5摩j的气体单质和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气。则所得无色晶体产物中,氙与氟的原子个数比是______,化学式为
。
(3)在一定体积的容器中,加入1.5摩j的气体单质和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气。则所得无色晶体产物中,氙与氟的原子个数比是______,化学式为
。
16.(8分)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)NH2-的电子式为 。 (2)N3-有 个电子。
(3)写出两种由多个原子组成的含有与N3-电子数相同的物质化学式 。
(4)等电子数的微粒往往具有相似的结构,预测N3-的最可能构型 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com