
题目列表(包括答案和解析)
5.一定条件下反应2AB(g) 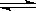 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
4.在2升的密闭容器中,发生以下反应:2A(g)+ B(g) 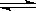 2C(g)+D(g)
。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)
。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
3.过程的自发性的作用是
A.判断过程的方向 B.确定过程是否一定会发生
C.判断过程发生的速率 D.判断过程的热效应
2. 下列说法正确的是
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
1.在2A+B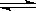 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
21.一定条件下,在密闭容器内将N2和H2以体积比为1∶3混合,当反应达平衡时,混合气中氨占25%(体积比),若混合前有100mol N2,求平衡后N2、H2、NH3的物质的量及N2的转化率。
20 实验室模拟合成氨和氨催化氧化的流程如下:
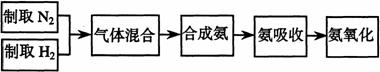
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:氮气 、氢气
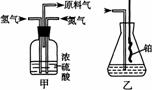 (2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
、
_.
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
、
_.
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
16(8分)已知氯水中有如下平衡:
Cl2 +
H2O HCl+HClO
HCl+HClO
常温下,在一个体积为50mL的针筒里吸入40mLCl2后,再吸进10mL水。写出针筒中可能观察到的现象______________________________。可将此针筒长时间放置,又可能看到何种变化________________;
试用平衡观点加以解释________________________。
 17(10分)如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:
17(10分)如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:

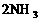 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:


(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:
①若a=1,c=2,则b=_____。在此情况下,反应起始时将向____(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_______,原因是______。
18(10分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl+K(g)(正反应为吸热反应)
NaCl+K(g)(正反应为吸热反应)
各物质的沸点与压强的关系见下表。
|
压强/kPa |
13.33 |
53.32 |
101.3 |
|
K的沸点/℃ |
590 |
710 |
770 |
|
Na的沸点/℃ |
700 |
830 |
890 |
|
KCl的沸点/℃ |
|
|
1437 |
|
NaCl的沸点/℃ |
|
|
1465 |
(1)在常温下金属钾转变为气态从反应混合物中分离的最低温度约为___________,而反应的最高温度应低于_________________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是_________________。
19(10分)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+
O2 (g) 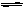 2SO3(g) ;△H<0
2SO3(g) ;△H<0
 (1)写出该反应的化学平衡常数表达式K=
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速度 (以上均填增大、减小或不变)
 (3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
。
 (4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
15.能够充分说明在恒温恒容下的密闭容器中,反应
2SO2+O2 2SO3已达平衡状态的标志是( )。
2SO3已达平衡状态的标志是( )。
A.容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B. SO2和SO3的物质的量浓度相等
C.反应容器内压强不随时间变化而变化
D.单位时间内生成2molSO3时,即生成1molO2
14.铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com