
题目列表(包括答案和解析)
8. 对于反应2SO2+O2 2SO3,下列判断正确的是( )
 A. 2体积SO2和足量O2反应,必定生成2体积SO3
A. 2体积SO2和足量O2反应,必定生成2体积SO3
 B. 其他条件不变,增大压强,平衡必定向右移动
B. 其他条件不变,增大压强,平衡必定向右移动
C. 平衡时,SO2消耗速度必定等于O2的生成速率
D. 平衡时,SO2浓度必定等于O2浓度的两倍
7. 下图为可逆反应A(g)+2B(g)
下图为可逆反应A(g)+2B(g) nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是( )
nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是( )
A. p2>p1,n<3
B. p2>p1,n>3
C. p1>p2,n<3 
D. p1>p2,n>3

6. 在一定温度下,把2. 0体积的N2和6. 0 体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2、6.0体积的H2和4.0体积的NH3
C. 4.0体积的NH3和1.0体积的H2
D. 2.0体积的NH3
5. 反应2A(g)  2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是(
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是(  )
)
A. 加压 B. 减压 C. 减少E的浓度 D. 降温
4. 在一密闭容器内发生氨分解反应:2NH3 N2+3H2。已知NH3起始浓度是2.6 mol·L-1,4s末为1.0 mol·L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为( )
N2+3H2。已知NH3起始浓度是2.6 mol·L-1,4s末为1.0 mol·L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为( )
A. 0.04 mol·L-1·s-1 B. 0.4 mol·L-1 ·s-1
C. 1.6 mol·L-1·s-1 D. 0.8 mol·L-1·s-1
3. 设反应C+CO2  2CO(正反应吸热)反应速率为v1,N2+3H2
2CO(正反应吸热)反应速率为v1,N2+3H2  2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为( )
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为( )
A. 同时增大 B. 同时减小
C. v1增大,v2减小 D. v1减小,v2增大
2. 某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)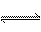 Z(g)+W(s)∶ΔH>0下列叙述正确的是(
Z(g)+W(s)∶ΔH>0下列叙述正确的是( )
)
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的ΔH增大
1. 将4 mol A气体和 2 mol B 气体在2 L容器中混合,并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
2C(g)若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( ) 
①用物质A表示的反应的平均速率为0.3 mol·L-1·S-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·S-1
③2 s时物质A的转化率为70%
 ④2 s时物质B的浓度为0.7 mol·L-1
④2 s时物质B的浓度为0.7 mol·L-1
 A.①③
B.①④
C.②③
D.③④
A.①③
B.①④
C.②③
D.③④
33.在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300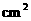 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g) 2C(g);H=-180 kJ·
2C(g);H=-180 kJ·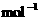
 (1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J·
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J·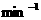 ·
·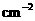 ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
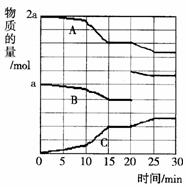
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是_____ ___。
A.10-15 min可能是加入了正催化剂
B.10-15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
32.某温度下,向某密闭容器中加入相对平均分子质量为8.5的N2和H2的混合气体4mol使之反应合成氨,达平衡后测得NH3的体积分数为m。保持温度不变,只改变起始物质的加入量使反应重新达到平衡后,NH3的体积分数仍为m。
若N2、H2、NH3的加入量分别用x、y、z表示,则x、y、z应满足:
①温度、体积恒定时,若x=0,y=0,则z= ;
温度、压强恒定时,若x=0,y=0,则z ;
②温度、体积恒定时,若x=0.75mol,则y= ,z= ;
温度、压强恒定时,若x=0.75mol,则y= ,z ;
③温度、压强恒定时,x、y、z应满足的关系是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com