
题目列表(包括答案和解析)
4.乙酸蒸气能形成二聚分子: 2CH3COOH(气) (CH3COOH)2(气);⊿H<0。现欲测定乙酸的相对分子质量,应采用的反应条件是: ( )
A.低温高压 B.高温低压 C.低温低压 D.高温高压
1.
 4NH3(g)+5O2(g)== 4NO(g)+6H2O(g),该反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的平均速率为
( )
A. V(O2)=0.01mol•L-1•s-1 B.V(NO)=0.008 mol•L-1•s-1
C.V(H2O)=0.003 mol•L-1•s-1 D.V(NH3) =0.003 mol•L-1•s-1
2. 把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:
3X(g)+Y(g)== n Z(g)+2W(g);
5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol•L-1•min-1,则上述反应中Z气体的反应方程式系数n的值是
( )
A.1 B.2 C.3 D.4
3.一定温度下,在2L的密闭容器中,X 、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
4NH3(g)+5O2(g)== 4NO(g)+6H2O(g),该反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的平均速率为
( )
A. V(O2)=0.01mol•L-1•s-1 B.V(NO)=0.008 mol•L-1•s-1
C.V(H2O)=0.003 mol•L-1•s-1 D.V(NH3) =0.003 mol•L-1•s-1
2. 把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:
3X(g)+Y(g)== n Z(g)+2W(g);
5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol•L-1•min-1,则上述反应中Z气体的反应方程式系数n的值是
( )
A.1 B.2 C.3 D.4
3.一定温度下,在2L的密闭容器中,X 、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是: ( )
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
 D.反应的化学方程式为:X(g)+Y(g)
D.反应的化学方程式为:X(g)+Y(g)
 Z(g)
Z(g)
6.(16分)恒温下,将a mol
N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)
(1)若反应在某时刻t时,n t (N2) = 13mol,n t(NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比,n(始)∶n(平) = 。(最简整数比)
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。

5. (10分)(1)在实验室中作小型实验:把物质A、B按一定比例充入一个表面积为 的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应
的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应 ,若平均每分钟生成0.5
mol的C,容器表面向外散热速率平均为
,若平均每分钟生成0.5
mol的C,容器表面向外散热速率平均为 为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
答:_________________________________________.
(2)若将(1)的小型实验扩大为工业生产:将反应容器的底面半径和高度都扩大到原容器的10倍,做成“相似体”,并向其中将A、B按原比例充入,使压强仍为P,然后加热到280℃使反应开始.为了维持恒温280℃,反应开始后,应继续加热还是进行冷却?(设容器表面散热速率不变)
平均每分钟用加热器向体系提供或者用冷却器吸收了多少kJ的热量.(简述推理过程)
答:________________________________________.
(3)在恒温、恒压下,向(2)的“相似体”平衡体系中将A、B按原比例充入,重新达到平衡时,C的体积分数_________.
4. 将5.6g铁粉投入足量的100mL2mol·L-1稀硫酸中,2min时铁刚好完全溶解,下列有关这个反应的速率表示正确的是(
将5.6g铁粉投入足量的100mL2mol·L-1稀硫酸中,2min时铁刚好完全溶解,下列有关这个反应的速率表示正确的是(  )
)
A.铁的反应速率是0.5mol·L-1·min-1
B.硫酸的平均反应速率是0.5mol·L-1·min-1
 C.硫酸亚铁的平均反应速率是0.5mol·L-1·min-1
C.硫酸亚铁的平均反应速率是0.5mol·L-1·min-1
D.氢气的反应速率是0.5mol·L-1·min-1
3. 合成氨反应为N2+3H2 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等) ( )
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等) ( ) 
A. 恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
B. 恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
C. 恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3
D. 恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3
2. 在373 K时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始的1.6倍。 下列说法正确的是( )
A. 前2 s,以N2O4的浓度表示的平衡反应速率为0. 01 mol·L-1·s-1
B. 在2 s时体系内的压强为开始时的1. 1倍
C. 在平衡时体系内含N2O4 0. 25mol
D. 平衡时,如果压缩容器体积,则可提高N2O4的转化率
1. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图1-2-6所示的变化规律(图中P表示压强,T表示温度, n表示物质的量):
n表示物质的量):

图1-2-6
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,P2>P1 B.反应Ⅱ:ΔH<0,T1<T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1  D.反应Ⅳ:ΔH<0,T2<T1
D.反应Ⅳ:ΔH<0,T2<T1
20. (10分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:

(1)降低温度,SO2的转化率_________,化学反应速度_________。
(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是__ _______。
_______。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
 B卷(能力提高卷)
B卷(能力提高卷)
19. (12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则: 
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
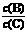 (4)若升高温度,则平衡时B、C的浓度之比 将_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com