
题目列表(包括答案和解析)
5.在HClO溶液中,可促进HClO的电离,并使pH增大的是
①加入HCl ②加入NaClO ③加入NaOH ④加入H2O
A.①②③④ B.②③④ C. ③④ D. ②④
4.用0.1mol/LNaOH溶液中和0.1mol/L盐酸,若在溶液呈中性时又多加了1滴NaOH溶液
(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
3.在一定条件下发生下列反应,其中属于盐类水解反应的是
A.Cl2+H2O 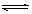 H++Cl-+HClO B.NH4+
+2H2O
H++Cl-+HClO B.NH4+
+2H2O 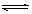 NH3·H2O
+ H3O+
NH3·H2O
+ H3O+
C.HS-+H+=== H2S D.HCO3- + H2O 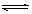 H3O+
+ CO32-
H3O+
+ CO32-
2.下列溶液中加入少量NaOH固体导电能力变化不大的是
A.盐酸 B. CH3COOH C. NH3·H2O D. H2O
1.下物质分类组合正确的是
|
|
A |
B |
C |
D |
|
强电解质 |
HBr |
AlCl3 |
H3PO4 |
Ca(OH)2 |
|
弱电解质 |
HF |
HCOOH |
BaSO4 |
HI |
|
非电解质 |
NH3 |
Cu
|
H2O
|
C2H5OH |
2. 请将选择题答案涂在答题卡上。考试完毕,只交答题卡和第Ⅱ卷 ⅠⅡ
可能用到的数据:相对原子质量 :H 1 C 12 O 16 S 32 Ba 137
第Ⅰ卷(选择题,54分)
(每小题3分,共54分,每小题只有一个选项是符合题目要求的)
22、已知:在298K、100kPa时,
①C(s,石墨)+O2(g) = CO2(g) △H1 = -400 kJ·mol-1;
②2H2(g)+O2(g) = 2H2O(l) △H2 = -570 kJ·mol-1;
③2C2H2(g)+5O2(g) = 4CO2(g)+ 2H2O(l) △H3 = -2600 kJ·mol-1;
(1)写出298K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式
。
(2)现有一定量的乙炔在足量氧气中完全燃烧,放出热量650 kJ。将反应后的二氧化碳气体缓缓通入到含有0.5 mol Ca (OH)2的澄清石灰水中充分反应。
将反应后的物质分为a、b、c三等份,分别进行下列实验,回答相应问题:
①在a中加入少量的氢氧化钠溶液,写出反应的离子方程式
。
②加热b,发生反应的离子方程式 。
③在c中加入适量的FeCl3溶液,观察到的实验现象是
。
21、(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
 C.2H2(g)+O2(g)=2H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
 (2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为
 。
。
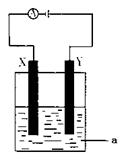
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与右图中
电解池相连,其中,a为电解液,X和
 Y是两块电极板,则:
Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4
溶液,则电解时的化学反应方程式为
。
通过一段时间后,向所得溶液中加入0.2molCuO粉末,
恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 。
20、在一定温度下,在一体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:

 2X(g)+Y(g) a
Z(g)+W(g) △H=-Q kJ·mol-1(Q>O)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
2X(g)+Y(g) a
Z(g)+W(g) △H=-Q kJ·mol-1(Q>O)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________________,其理由是____________________________________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、O.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_______________________(用含Q、Q1的代数式表示)。
19、北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g);△H1=156.6 kJ·mol-1
 CH3CH=CH2(g) =CH4(g)+HC≡CH(g);△H2=32.4
kJ·mol-1
CH3CH=CH2(g) =CH4(g)+HC≡CH(g);△H2=32.4
kJ·mol-1
则相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
 (2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为____________________________________________________;放电时,CO32-移向电池的_____ __(填“正”或“负”)极。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为____________________________________________________;放电时,CO32-移向电池的_____ __(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3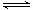 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_______________________________________________________________
______________________________________________________________________________(用离子方程式和必要的文字说明)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com