
题目列表(包括答案和解析)
15.要使0.1 mol/L的醋酸溶液中c(H+)/c(CH3COOH)值增大,pH增大,可采取的措施是
A.加少量CH3COONa固体 B.升高温度 C.加少量冰醋酸 D.加水
14.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO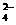 )>c(NH
)>c(NH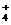 ))>c(Cu2+)>c(H+)>c(OH-)
))>c(Cu2+)>c(H+)>c(OH-)
C.将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时:c(NH4+)=2c(SO42-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
13.下列各组离子不可能大量共存的是
A.能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO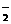
B.能与金属铝反应放出氢气的溶液中: K+、SO42-、Cl-、NH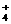
C.250C时,某溶液中由水电离出的c(OH-)=1×10-13 mol/L:
NH4+ 、Fe3+ 、SO42- 、Cl-
D.含有HCO3-的溶液中:K+、OH-、NO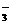 、Ca2+
、Ca2+
12.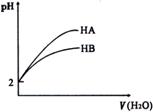 pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如右图所示。则下列叙述正确的是
pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如右图所示。则下列叙述正确的是
A.电离平衡常数HA>HB
B.等体积的HA和HB与等浓度的NaOH反应,HA消
耗的NaOH多
C.等体积的HA和HB与等质量的Zn反应,HA平均反应速率大
D.若有等浓度的NaA、NaB,则碱性NaA>NaB
11.下列离子方程式中,正确的是
A.氯气通入氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
B.盐酸与石灰石反应:2H++CO32-=H2O+CO2↑
C.足量石灰水与Ca(HCO3)2反应:Ca2+ +HCO3- + OH- = CaCO3↓+H2O
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-= BaSO4↓
10.在醋酸与氢氧化钠溶液的反应完成后,溶液中的相关离子浓度呈现出下列排列顺序:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应可能是
A.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合
B.0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合
C.CH3COOH与NaOH溶液混合后所得溶液的pH=7
D.0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合
9.25 ℃时,水的电离达到平衡:H2O H++OH-;DH>0,下列叙述正确的是
H++OH-;DH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水中加入少量固体NH4Cl,平衡正向移动,c(H+)降低
8.常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得溶液的pH A.等于7 B.大于7 C.小于7 D.无法确定
7.下列溶液蒸干后得到的固体,仍是原溶质的是
A.K2CO3溶液 B.Na2SO3溶液 C.Mg(HCO3)2溶液 D.FeCl3溶液
6.常温下,某pH=1的一元酸HA的溶液中,HA的电离度为10%;某0.1 mol/L的一元碱BOH溶液中,c(OH-)/c(H+)=1012。将上述两种溶液等体积混合后,若混合后溶液的体积变化忽略不计,下列推论错误的是
A.BOH是一元强碱 B.c(A-)>c(B+)
C.混合后,溶液呈碱性 D.c(H+)/c(A-)值减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com