
题目列表(包括答案和解析)
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
24.(6分)pH=12的NaOH溶液100mL,要使它的pH变为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加入100 mL盐酸,其浓度为 mol/L。
23.(6分)常压下,加热NaHCO3饱和溶液,测得溶液的pH变化如下表
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液升温后pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,而Na2CO3的水解程度大小NaHCO3,所以pH升高。
丙同学设计如下方案探究甲、乙的判断。
(1)在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,乙判断正确。试剂X是
(填序号)。
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙确定 (填“甲”或“乙”)判断是错误的,理由是 。
22.(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生
第二份加足量NaOH溶液加热后,收集到0.04mol气体
第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物中可能存在的离子有 。
(2)由第二份进行的实验得知混合物中应含有 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知6.27g沉淀的成分为 。
请计算形成这些沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-
B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl-
21.(7分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
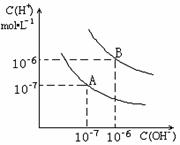
(1)25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的
pH=7,则NaOH溶液与溶液的体积比为 。
(2)95时,若pH=a的某强酸溶液与pH=b的某强碱溶液等体积混合后溶液呈中性,则a与b应满足的关系是 。
(3)曲线B对应温度下,pH=2的某酸HA溶液和pH=10的NaOH 溶液等体积混合后,混合溶液的pH=5。请分析其原因:
20.(8分)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④含0.1molNH3·H2O和0.1molNH4Cl的混合液1L ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞。
(2)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)。
(3)在溶液④中, 离子的浓度为0.1mol/L;c (NH3·H2O)和c(NH4+)之和为 mol/L。
(4)若溶液②的pH=7,则c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)。
19.(9分)
(1)现有0.1mol·L-1的纯碱溶液,其溶液呈 性,原因是(用离子方程表示) 。
(2)欲使0.1mol·L-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是 。
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是 。
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
(4)为探究纯碱溶液呈碱性是由CO32-引起的,请你用纯碱溶液、酚酞、氯化钙溶液做试剂设计一个简单的实验方案 。
(5)有资料记载:常温下,0.1mol·L-1的纯碱溶液,发生水解的CO32-离子不超过其总量的10%。请你用pH试纸设计实验验证之 。
18.已知25℃时,AgI的饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/Lmol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
第Ⅱ卷(非选择题,46分)
17.要将pH=1体积为a mL的盐酸变为pH=2(近似认为不同浓度的盐酸密度相同),下列采取的措施能够达到预期目的的是
A.加热蒸发到溶液体积为0.5a mL B.加入a mL蒸馏水
C.加入10a mL的pH=3的盐酸 D.加入0.5a mL与盐酸相同浓度的NaOH溶液
16.下列过程或现象与盐类水解无关的是
A.纯碱溶液加热可增加去污效果 B.铁片在潮湿的环境下表面形成红棕色水膜
C.加热氯化铁溶液颜色变深 D.NaHCO3溶液遇酚酞试剂呈粉红色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com