
题目列表(包括答案和解析)
5. 下在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通时,理论上的两极变化是( )
①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1 gH2 ④铜片上析出1mol H2
A. ①③ B. ①④ C. ②③ D. ②④
4. 理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H<0
B.HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)==2H2O(l) △H<0
D.2FeCl3(aq)+Fe(s)==3FeCl3(aq) △H<0
3. 对于原电池的电极名称,叙述有错误的是( )
A. 发生氧化反应的一极为负极 B. 正极为电子流人的一极
C. 比较不活泼的金属为负极 D. 电流流人的一极为正极
2. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大 D. 产生气泡的速度甲比乙慢
1. 下列关于原电池的叙述正确的是( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是将化学能转变为电能的装置
C. 在原电池中,电子流出的一极是负极,该电极被还原
D. 原电池放电时,电流的方向是从负极到正极
21. (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近的O2-核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近的O2-核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算晶体中Ni3+与Ni2+的离子数之比 。
20.

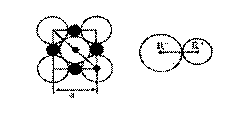
 晶胞是晶体中最小重复单位,并在空间不断伸展构成晶体。NaCl晶体是一个正六面体(如图)。我们把阴、阳离子看成不等径的圆球,并彼此相切,离子键的键长是相邻阴阳离子的半径之和(如图)。已知a为常数,请计算下列问题:
(1)每个晶胞中平均分摊____个Na+,____个C1-。
晶胞是晶体中最小重复单位,并在空间不断伸展构成晶体。NaCl晶体是一个正六面体(如图)。我们把阴、阳离子看成不等径的圆球,并彼此相切,离子键的键长是相邻阴阳离子的半径之和(如图)。已知a为常数,请计算下列问题:
(1)每个晶胞中平均分摊____个Na+,____个C1-。
(2)NaCl晶体离子键的键长为_____,Na+离子半径与Cl-离子半径之比为 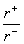 =______。
=______。

(3)NaCl晶体不存在分子,但在高温下(≥1413℃时)晶体转变成气体NaCl的分形式存在,现有1mol NaCl晶体,加强热使其气化,测得气体体积为11.2升(已折为标况)。则此时氯化钠气体的分子式为 。
19、有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。
(2)B的氢化物的电子式为______,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为______,属______分子(极性或非极性),其晶体类型是______。俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)_______________________。
(5)C和D的化合物溶于水后滴入过量KOH,现象是_______________________________,离子方程式_______________________________。
18、某离子晶体晶胞结构如下图所示,x位于立方体的顶点,
 Y位于立方体中心。试分析:
Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹∠XYX的
度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
17、 二氧化硅晶体是立体的网状结构,其晶体模型
二氧化硅晶体是立体的网状结构,其晶体模型
如右图所示。认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小的环为 元环。
 (2)每个硅原子为 个最小环共有。
(2)每个硅原子为 个最小环共有。
(3)每个最小环平均拥有 个氧原子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com