
题目列表(包括答案和解析)
24. 已知某元素的电离能(IA/kJ*mol-1):I1=577;I2=1820;I3=2740;I4=11600;I5=14800;I6=18400;I7=23400,试回答:
(1)当1mol该元素原子失去3mol电子时消耗的能量是多少?
(2)该元素是否存在+1价离子?为什么?
23. X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。回答下列问题:
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为 ,乙的电子式为 。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂, 甲的电子式 ,乙的化学式为 。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y原子基态电子排布式为 。
22. 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1) 写出Fe2+的核外电子排布式
(2) 用轨道表示式表示Fe3+的3d电子的排布情况
(3) Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,ClO-的电子式是 ,Fe(OH)3与NaClO反应的化学方程式是 。
(4) 硫酸亚铁制备中实验步骤①的目的是 。
(5) 实验步骤②明显不合理,理由是 。
(6) 实验步骤④中用少量冰水洗涤晶体,其目的是 。
21. A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
根据以上信息,回答下列问题:
(1)比较A和D的氢化物,后者的沸点较低,其原因是
(2) B的离子结构示意图为 ,元素C在元素周期表中的位置是 ;
(3) A和E形成的化合物的电子式是 ,它的晶体类型为 晶体。
(4)C原子的电子排布式是 。
20. 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。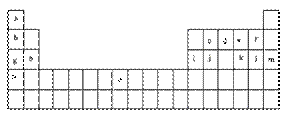
试回答下列问题
(1)元素“o”在周期表中的位置是 。
(2)画出“c”的价电子排布式 。
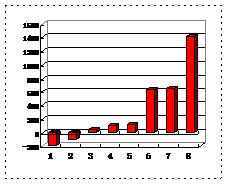
 (3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表
(填元素符号,下同),“7”代表
。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表
(填元素符号,下同),“7”代表
。
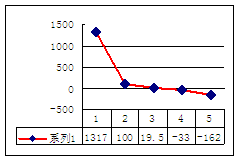
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为:
;序列“1”氢化物的电子式为: 。
19、. 下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
|
最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。
(3)某元素R的原子半径为1.02×10-10m,该元素最高价氧化物的水化物化学式为 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你尝试写出该化合物的电子式 。
18. 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
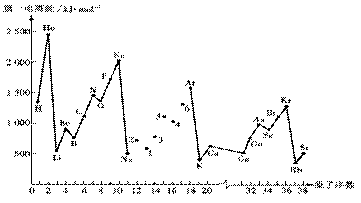
请回答以下问题:
⑴ 认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图像。
⑵ 从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶ 上图中5号元素在周期表中的位置是_____________、_______________;
⑷ 上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5) 同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是______。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
17. 某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小的,其核外电子排布式为 ,价电子构型为 ,属 区元素
16. 据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是
A.NaCl B.H2O C.NaHCO3 D.Al2O3
15.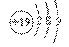 下列说法正确的是
下列说法正确的是
A.钾(K)原子基态的原子结构示意图为
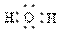 B.H2O电子式为
B.H2O电子式为
C.Mg的原子基态电子排布式为1s22s22p63s23p1
D.Ca2+离子基态电子排布式为1s22s22p63s23p6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com