
题目列表(包括答案和解析)
5.下列说法正确的是
A.在Na2O2晶体中阳离子与阴离子的物质的量之比为l:1
B.离子晶体中一定含有金属阳离子
C.水加热到很高的温度都难以分解是因为水分子间存在氢键
D.用鸡蛋壳内膜和蒸馏水除去淀粉胶体中的食盐
4.2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。三聚氰胺的分子式为C3N3(NH2)3, 在一般情况下较稳定,但在高温下可能会分解放出氰化物。下列有关三聚氰胺的说法不正确的是
A.三聚氰胺的摩尔质量为126
B.用三聚氰胺制造的餐具不可以放进微波炉中加热使用
C.三聚氰胺中C、N两种元素的质量比为3:7
D.三聚氰胺中氮元素的质量分数约为66.7%
3.下列关于物质性质的比较,正确的是
A.NaF、NaCl、NaBr、NaI的熔点依次升高 B.熔点:铯>钾>钠>钠和钾的合金
C.熔沸点:HI>HBr>HCl>HF D.热稳定性:HF>HCl>HBr>HI
2.2008年诺贝尔化学奖授予钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白(一种蛋白质,简称GFP)方面做出的杰出贡献。下列有关GFP的说法错误的是
 A.属于高分子化合物
B.遇到CuSO4溶液会发生盐析
A.属于高分子化合物
B.遇到CuSO4溶液会发生盐析
C.水解后可得到多种氨基酸 D.可用于蛋白质反应机理的研究
1.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质:①是溶液,②是胶体,③能产生丁达尔效应,④能透过滤纸,⑤能透过半透膜,⑥静置后,会析出黑色沉淀,叙述正确的是
A.①④⑥ B. ②③⑤ C.②③④ D.①③④⑥
25.A、C两种元素的原子的最后一个电子都填充在s亚层中,1 mol的A单质同水反应生成1 g H2,同时转化为具有Ne原子电子层结构的离子。B的核电荷数比A少5个,B与C可形成正四面体的共价化合物D,原子半径A、B、C依次递减,试判断:
(1)A、B、C各为何种元素?
(2)哪个元素的原子最外层的电子能量最高?写出能量最高的电子所处的电子亚层符号。
 (3)写出D的电子式和结构式。
(3)写出D的电子式和结构式。
(4)写出A的氧化物的电子式。

24.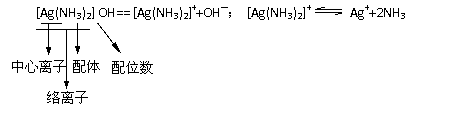 信息:
信息:
有两种化合物,A:COCl3·5NH3·H2O;B:COCl3·5NH3·H2O,根据下面的实验结果,确定它们的络离子、中心离子和配体。
⑴分别取A和B的固体于试管中微热,A中未见明显现象,B中试管口出现少量水珠。
⑵向A和B的溶液中加入AgNO3溶液后均有AgCl沉淀。
⑶沉淀过滤后,分别向滤液中加AgNO3溶液均无变化,但加热煮沸,B溶液中又有AgCl沉淀生成,其沉淀量为原来B溶液中AgCl的一半。
又已知该化合物中心离子配位数均为6,试按照“[Ag(NH3)2] OH”的书写格式写出A、B的化学式: A ____________,B ______________。
23.20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节都实现净化和无污染的反应途径。试回答下列问题:
(1)下列各项属于“绿色化学”的是 ( )
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源
 (2)在我国中西部大开发中,某省为筹建一大型化工基地征集到下列方案,其中你认为可行的是 ( )
(2)在我国中西部大开发中,某省为筹建一大型化工基地征集到下列方案,其中你认为可行的是 ( )
A.建在中西部干旱山区可以帮助当地居民脱贫致富
 B.应建在水资源丰富和交通方便的远离城市的郊区
B.应建在水资源丰富和交通方便的远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)对聚丙烯酸废弃物(白色污染物中的一种)的降解,国际上最新采用了热聚门冬氨酸或其盐(TPA),它有效、廉价且自身可被生物降解。废弃物自身被生物降解的意义是 。
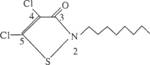 (4)1996年美国罗姆斯公司的Willingham G L等人因研制出对环境安全的船舶防垢剂--“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如下所示。
(4)1996年美国罗姆斯公司的Willingham G L等人因研制出对环境安全的船舶防垢剂--“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如下所示。
试回答下列问题:
①“海洋9号”的化学式为 。
②能在一定条件下与H2发生加成反应的碳原子是 (用2,3,…,5等数字填写)。
③4、5位碳原子上连接的两个氯原子能否发生取代反应? (填“能”或“不能”)。如能发生,请举一例,用化学方程式表示:
22.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
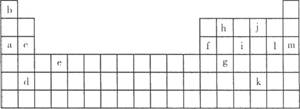
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a,c,h ②b,g,k ③c,h,1 ④d,e,f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:一是原子核对核外电子的吸引力;二是形成稳定结构的倾向。
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
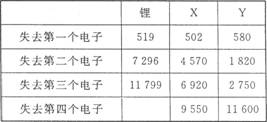
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 。 ②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示x和j形成化合物的化学式: 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子的第一电离能最大。
21.下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 __(填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)_______________________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
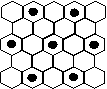
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___ 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com