
题目列表(包括答案和解析)
23.(每空1分,共7分)A+、B-、C、D四种微粒均含有氢原子,且含有的电子总数均为10个,A+与B-在加热时反应生成C和D。问
(1)A+、B-的电子式分别是A+ 、B- ;
(2)若B-和含有10个电子的微粒E+发生如下反应B-+E+=2D,则C、D、E+的化学式是:C 、D 、E+ 。
(3)C、D两种分子的空间构型分别为 、 。24. (每空1分,共4分)有几种元素的粒子的核外电子层结构如下图所示:
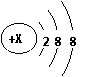
据图回答:
(1)其电中性粒子,一般不和其它元素的原子反应,这种粒子的名称是 。
(2)某粒子的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种粒子符号是 。
(3)某粒子氧化性甚弱,但得到电子后还原性较强。且这种原子最外层只有一个成单电子,这种粒子符号是 。
(4)某粒子具有还原性,且这种粒子失去2个电子即变成原子,这种粒子符号是 。
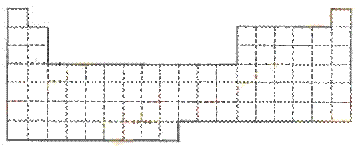 25(10分)
25(10分)
(1) 在上面元素周期表中画出金属元素与非金属元素的分界线。
 (2) 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的
族。
(2) 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的
族。
(3) 现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素价电子排布为3s1。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),

|
图1 |
(4)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(5)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________
甲、乙的最高价氧化物水化物的酸性强弱为:________>________ (用化学式表示)。
 (6)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:
(6)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:
__________________________________________________ _
____________________________
22.(6分)已知某元素的原子序数是26,试推测:
(1)该元素的电子排布式 ;
(2)该元素处在哪一周期?哪一族?是主族还是副族?
;
(3)该元素是金属元素还是非金属元素? ;
(4)该元素的最高化合价是多少? 。
21. (每空0.5分,共6分)指出下列元素的名称和原子序数,写出其价电子排布式。
(每空0.5分,共6分)指出下列元素的名称和原子序数,写出其价电子排布式。
(1)原子中4p轨道半充满的元素;
、 、 ;
(2)原子中3d轨道半充满的元素;
、 、 ;
、 、 ;

(3)第2周期的稀有气体元素。
、 、 ;
20.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含的中子数为8 B.NH3的结构式为
C.HCl的电子式为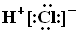 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
第Ⅱ卷(共40分)
19.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.H2O C.SiCl4 D.PCl5
18.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是 ( )
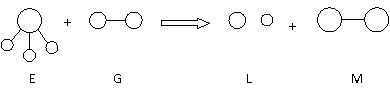




A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
17.下列各项中表达正确的是 ( )
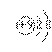 A.F-的结构示意图: B.CO2的分子模型示意图:
A.F-的结构示意图: B.CO2的分子模型示意图:
C.NaCl的电子式: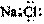 D.N2的结构式:
:N≡N:
D.N2的结构式:
:N≡N:
16.下列叙述正确的是:
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D. CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
15.可以判断化合物晶体内一定存在离子键的依据是
A.可溶于水 B.水溶液能导电 C.具有较高的熔点 D.熔融状态能导电
14.已知元素X的原子序数大于元素Y的原子序数,X、Y间形成的常见化合物可表示为Y2X、Y2X2,则这两种元素形成的化合物Y2X2中
 A.只有极性共价键 B.只有非极性共价键 C.有离子键,也有共价键
A.只有极性共价键 B.只有非极性共价键 C.有离子键,也有共价键
D.既有极性键,又有非极性键,还是极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com