
题目列表(包括答案和解析)
4.有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管观察到的现象是______________________;被检出的物质的化学式(分子式)是______________________。
(2)分别向未检出的溶液中加入上述已检出的溶液,观察到的现象和相应的离子方程式是:
1支试管中有白色沉淀生成,______________________;
2支试管中有蓝色沉淀生成,______________________、______________________。
 被检出的物质的化学式(分子式)是______________________。
被检出的物质的化学式(分子式)是______________________。
(3)鉴别余下未检出物质的方法和观察到的现象是:
(i)____________________________________________;
(ii)____________________________________________。
3.有五种白色粉末,已知它们分别是MgCl2、NaCl、(NH4)2SO4、(NH4)2CO3、KNO3。试设计实验鉴别它们。
1.有一瓶绿色的硫酸亚铁晶体,由于保存不善,又放置较长时间,怀疑它可能被氧化。试用实验证明它是部分被氧化,还是全部被氧化?简要写出实验主要步骤、结论和报告。
 2.Cu+在酸性溶液中不稳定,可发生自身氧化还原反应,生成Cu2+和Cu。现只有稀硫酸、浓硝酸、稀硝酸、氯化铁溶液和pH试纸,而没有其他试剂,简述用最简便的实验方法来检验CuO经氢气还原后所得的红色产物中是否含有碱性氧化物Cu2O。
2.Cu+在酸性溶液中不稳定,可发生自身氧化还原反应,生成Cu2+和Cu。现只有稀硫酸、浓硝酸、稀硝酸、氯化铁溶液和pH试纸,而没有其他试剂,简述用最简便的实验方法来检验CuO经氢气还原后所得的红色产物中是否含有碱性氧化物Cu2O。
23.(18分) (1)D(2分) (2)C(2分)
(3)①NH3•H2O和NH4+(共2分,均答对给分)②NH4+和H+(共2分,均答对给分)
(4) ① 氯化铵 ,A (各2分 ② NH4Cl和HCl (2分)③ < ,= 各2分)

22.(12分)(每题各3分,分别1分,2分)
(1)碱性,>; (2)酸性,<; (3)中性,>; (4)<,>。
21.(16分)(每空2分,共16分)
(1)酸,< ,Ag+ + H2O 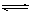 AgOH + H+ ,抑制 。
AgOH + H+ ,抑制 。
(2)酸,Al3++3H2O 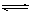 Al(OH)3+3H+, Al2O3
;(3)NaOH。
Al(OH)3+3H+, Al2O3
;(3)NaOH。
11.B 12.A 13.AD 14.C 15.B 16.BC 17.C 18.B 19.C 20.CD
23.(18分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)_ _。
A.9 B.13 C.11-13之间 D.9-11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ 。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① __ 和_ 两种粒子的物质的量之和等于0.1mol。
②_ __和_ _两种粒子的物质的量之和比OH―多0.05mol。
 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。


答案 1.C 2.B 3.D 4.C 5.B 6.A 7.C 8.D 9.B 10.B
22.(12分)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
21.(16分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示): 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com