
题目列表(包括答案和解析)
(二)溶质质量人数与溶解度的比较
|
溶质质量分数 |
溶解度 |
|
表示溶液的浓稀 |
表示溶质溶解性的大小 |
|
不受湿度的影响 |
受湿度的影响 |
|
不一定是饱和溶液 |
一定是饱和溶液 |
|
单位是一,省略不写 |
单位是克 |
(一)溶液计算知识结构
 定义 一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
定义 一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶质 被溶解的物质.
组成
溶剂 溶解其它物质的物质。
饱和溶液与不饱和溶液
浓溶液与稀溶液(溶质质量分数的高低)
溶解度的定义 略
内因 溶质、溶剂的性质
影响溶解度的因素(固体)
外因 湿度 压强(对气体而言)
(1)大多数物质“陡升型”如KNO3
固体溶解度随湿度变化情况 (2)少数物质“缓升型”如NaCl
(3)极少数物质“下降型”如Ca(OH)2
一定湿度下饱和溶液中溶质、溶剂、溶液的质量比
一定湿度下饱和溶液中溶质、溶剂、溶解度的相互换算
溶解度(克)= ×100(克)
×100(克)
溶质的质量分数= ×100%
×100%
溶质质量分数(a%)与体积(V)、密度(ρ)的有关计算
溶液质量m液=V·ρ
溶质质量m液=V·ρ·a%
溶解度(S)与饱和溶液溶质质量分数的换算
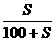 ×100%=a%
×100%=a%
4.能对溶液、化学方程式等计算进行综合运用。
3.通过联系实际和实验的有关计算,体会溶质质量分数计算的意义。
2.能够正确分析溶液加水稀释或加溶质变浓过程进行有关溶质质量分数变化的计算。培养分析和计算能力。
§4-3有关溶液的计算 §4-4综合计算
1.准确理解溶质质量分数及密度的概念,能够根据它们与溶质质量、溶剂质量、溶液质量和溶液体积之间的关系,时行有关换算,培养综合计算能力。
6.硫酸的质量分数; 5a.
第二讲:
5.(1)设金属元素R的相对质量为x。
则:x ×2:16 = 23:8 x=23
(2)设6.2gR2O与水反应生成ROH的质量为y。(也可以用Na代替R)
R2O + H2O == 2ROH
62 80
 =
=  y=8g
y=8g
根据题意思有: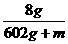 × 100%
× 100%
m=43.8g
即加入金属氧化物中水的质量为43.8g
5.6g x
(2)设混合物中Fe2O3的质量为y.
Fe2O3 + 3CO == 2Fe + 3CO2
160 112
y
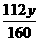 6.8g - y = 5.6g
-
6.8g - y = 5.6g
- 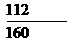 y=4g
y=4g
氧化铁的质量分数: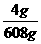 × 100% = 58。8%
× 100% = 58。8%
4.(1)设制得氢气的质量为x.
Fe + 2HCl == FeCl2 + H2↑
56
2
 =
=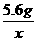 x=0.2g
x=0.2g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com