
题目列表(包括答案和解析)
1. 某化学课外小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器均未画出,“△”表示酒精灯热源),每套装置又划分为①、②、③三部分。仪器中盛放的试剂为:a、无水乙醇(沸点:78℃)b、铜丝;c、无水硫酸铜;d、新制氢氧化铜悬浊液。
某化学课外小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器均未画出,“△”表示酒精灯热源),每套装置又划分为①、②、③三部分。仪器中盛放的试剂为:a、无水乙醇(沸点:78℃)b、铜丝;c、无水硫酸铜;d、新制氢氧化铜悬浊液。
(1)简述三套方案各自的优点。

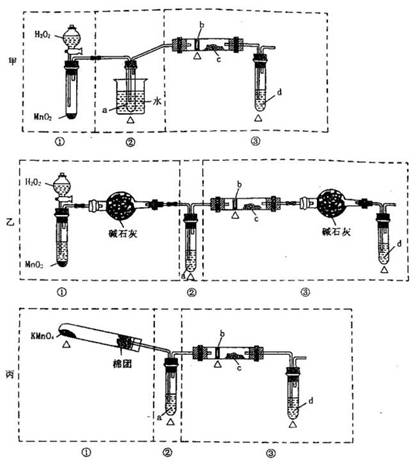
甲:_____________________________________________________
乙:_____________________________________________________
丙:____________________________________________________
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流由左到右的顺序表示为______________________________________________(例如:甲①,乙②,丙③)
(3)若要保证此实验有较高的效率,还需补充的仪器有_____________;理由是_____________________________________。
0.96 g残渣;
Ⅲ.将第三份试样隔绝空气加强热后,恰好生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质A是_________。 (2)混合物中的B的质量分数为__________。
(3)写出实验Ⅲ中有关反应的化学方程式并计算x的值。

13.本题中所有的气体体积均指标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中,A、B两元素同周期且原子半径A>B。分别取三份质量为 1.52 g的A、B的混合物(粉末)进行如下实验:
Ⅰ.向第一份试样中加入过量的盐酸,充分反应后放出0.896 L气体,还余0.56 g残渣;Ⅱ.向第二份试样中加入过量的10% 的NaOH溶液,充分反应后放出0.896 L气体,还余
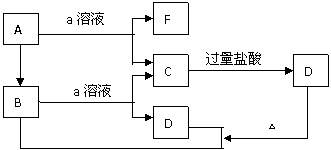
12.如下图所示的物质的转化关系中,A是一种固体单质,E是一种白色沉淀。据图填写:
(1)B的化学式是_________,目前B已被用作___________的主要原料。
(2)B和a溶液反应的离子方程式是_____________________________。
(3)A和a溶液反应的化学方程式是_____________________________。
(4)C和过量盐酸反应的离子方程式是____________________________。
11.把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比约大于15:24)混合均匀,装入试管中加热约1分钟后发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1) 写出河沙与镁粉在加热条件下的发生反应的化学方程式_________________________,该反应是__________反应(填“放热”或“吸热”)。
写出河沙与镁粉在加热条件下的发生反应的化学方程式_________________________,该反应是__________反应(填“放热”或“吸热”)。
(2)生成的混合物放入稀硫酸中,产生的气体是(填化学式)____________。
(3)写出产生爆炸声时发生反应的化学方程式________________________。
8. 解析:
解析:
这是一个设计性较强的实验题.从反应原理、试剂到仪器、步骤均要根据题意和已学知识一一分析,作出合理安排。
 首先,考虑根据什么反应原理,制得纯净的Na2CO3溶液?若在NaOH溶液中直接通入适量的CO2,使其只发生反应:CO2+2NaOH=Na2CO3+ H2O。显然,“适量”两字是难以实际控制的,题干也明确指出此种方法的不足。若在NaOH溶液中通入足量的CO2,使其生成NaHCO3溶液。再将其加热蒸干灼烧,使其分解为Na2CO3固体,最后溶于水。此方法步骤较多,操作复杂,且蒸干灼烧时也难以做到固体NaHCO3恰好完全分解,何况题中未给酒精灯。合理的思路是:依据如下反应:CO2 +NaOH
= NaHCO3,NaHCO3
+NaOH = Na2CO3
+H2O,两反应中消耗的NaOH量相等.这是关键,因而必须取两等份的NaOH同种溶液,使其中一份完全转化为NaHCO3,然而再加入另一份NaOH溶液,又使NaHCO3刚好转化为Na2CO3。
首先,考虑根据什么反应原理,制得纯净的Na2CO3溶液?若在NaOH溶液中直接通入适量的CO2,使其只发生反应:CO2+2NaOH=Na2CO3+ H2O。显然,“适量”两字是难以实际控制的,题干也明确指出此种方法的不足。若在NaOH溶液中通入足量的CO2,使其生成NaHCO3溶液。再将其加热蒸干灼烧,使其分解为Na2CO3固体,最后溶于水。此方法步骤较多,操作复杂,且蒸干灼烧时也难以做到固体NaHCO3恰好完全分解,何况题中未给酒精灯。合理的思路是:依据如下反应:CO2 +NaOH
= NaHCO3,NaHCO3
+NaOH = Na2CO3
+H2O,两反应中消耗的NaOH量相等.这是关键,因而必须取两等份的NaOH同种溶液,使其中一份完全转化为NaHCO3,然而再加入另一份NaOH溶液,又使NaHCO3刚好转化为Na2CO3。
其次,考虑怎样选择的合适的试剂和仪器?欲制CO2,选用哪一种碳酸盐和哪一种酸?
因要用启普发生器,K2CO3固体可溶于水,不能选用。Cu2(OH)2CO3、大理石均为不溶于水的固体.但CaCO3、Cu2(OH)2CO3分别与HCl的反应产生等量的CO2,后者将消耗更多的HCl,故应选用CaCO3。由于CaCO3和H2SO4反应生成CaSO4微溶物,覆盖在CaCO3固体表面,使反应速率降低.故应选择盐酸.但现有两种不同的盐酸,该选择浓的还是稀的?由于浓盐酸具有挥发性,使CO2中混有HCl,从而与NaOH反应将有NaCl生成,最终无法制得纯净的Na2CO3溶液.故应用稀HCl。
7.2CO2+2Na2O2=2Na2CO3 +O2↑ 2H2O +2Na2O2 =4NaOH+O2 ↑
补充适量的水蒸气
6.D 根据题意,把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,只能让NH4Cl结晶析出。在0~10℃NH4Cl溶解度小,通入NH3可与NaHCO3反应生成NH4+,增大NH4+浓度,加入NaCl可以增大Cl-浓度,有利于NH4Cl析出。
5.B 在本题中,最后都形成氢氧化钾溶液,且溶质为等量的氢氧化钾。水是足量等量的,水起两个作用,一个是反应物,另一个是溶剂(氢氧化钾中,水只做溶剂)。如果反应耗水越多,溶剂水就越少,溶液的质量分数就越大。所以本题的关键是看含等量钾元素的物质耗水的情况。根据反应得关系式4K-4H2O,2K2O2-2H2O,4KO2-2H2O,4KOH-0H2O,所以可知溶液的质量分数为丁<乙=丙<甲。
4.D 由题给条件可知,将甲蒸发掉一半水分,溶质的量并未发生变化,故完全反应时,消耗的盐酸应与丙相同。乙通入少量CO2,部分NaOH转化为Na2CO3,由于存在关系:
2NaOH-Na2CO3-2HCl,生成的Na2CO3消耗HCl,与变质前NaOH消耗HCl等量,故完全反应后,所需盐酸的体积应是相等的,即甲=乙=丙。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com