
题目列表(包括答案和解析)
6. X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4
⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )
A.② D.②④ C②⑤⑥ D.①②③④
7 下列分子中,所有原子都满足最外层为8电子结构的是( )
A.BF3 B.PCl5 C.HCl D.CF2Cl2
5.已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
A. A、B、D不可能在同周期
B.D一定在第二周期
C.A、D可能在同一主族
D.C和D的单质可能化合为离子化合物
4.下列物质的电子式书写正确的是( )
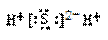 A.NaCl
A.NaCl
 B.H2S
B.H2S
C.-CH3 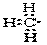 D.NH4I
D.NH4I 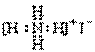
3.下列化合物中,既有离子键,又有共价键的是 ( )
A.CaO B.SiO2 C.H2O D.Na2O2
2.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
1. 1919年,科学家第一次实现了人类多年的梦想--人工转变元素。这个核反应如下:
1919年,科学家第一次实现了人类多年的梦想--人工转变元素。这个核反应如下: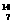 N+
N+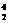 He→
He→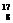 O+
O+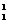 H下列叙述正确的是 ( )
H下列叙述正确的是 ( )
 A.
A.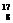 O原子核内有9个质子 B.
O原子核内有9个质子 B.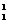 H原子核内有1个中子
H原子核内有1个中子
C.O2和O3互为同位素 D.通常情况下,He和N2化学性质都很稳定
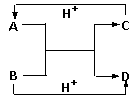
28.(8分)A、B、C、D是中学化学中常见的含有相同电子数的离子或分子。其中A是由5个原子构成的粒子。它们之间的相互反应关系如下图。
⑴写出A、B的电子式。A B 。
⑵C与D相似,在液态时C也可以发生微弱的电离,电离出含有相同电子数的两种微粒,则C的电离方程式为____________________________________。
⑶金属钠能与液态C反应:Na+C→X+H2,写出在液态C中X跟NH4Cl反应的化学方程式 。
27.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
 ⑴甲、乙两分子中含有非极性共价键的物质的电子式是___________________,C元素在周期表中的位置是______________________。
⑴甲、乙两分子中含有非极性共价键的物质的电子式是___________________,C元素在周期表中的位置是______________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
 ⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是__________________________________________________。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是__________________________________________________。
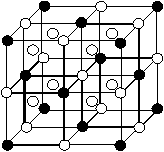
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。
 |
|||||
 |
|||||
|
|||||

26.(10分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系_____________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系________________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某化合物分子中含有S-N键,你认为该共用电子对偏向于________原子(填元素符号)。
25、(10分)在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z。若已知:
①反应前的X与反应后生成的Z的物质的量之比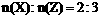
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是___________,单质Z是___________(填写名称或分子式)。
(2)Y分子中共含___________个共价键。
(3)X分解为Y和Z的化学方程式为:______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com