
题目列表(包括答案和解析)
29. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________,乙物质的电子式是____________·
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________
(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是_________ __。
28. 下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
 ④ ④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 __(填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)_______________________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
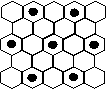
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___ 。
27、1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1) 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:
_________<X<_________。
(2) 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
____________________________________________________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________________________________________________________。
(3) 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是
_____________________________________________________________________
 _____________________________________________________________.
_____________________________________________________________.
26. 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)请写出下列元素的元素符号:
B________________ D______________ E_______________。
(2)写出B、D两元素组成的非极性分子的电子式_____________________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出2种即可)
_____________________、________________________。
(4)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:___________________________________________。
25、A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息回答下列问题:
(!)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)
(2)元素C在元素周期表中的位置是 。

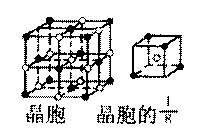
 (3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“ ”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心。该化合物的电子式是
。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“ ”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心。该化合物的电子式是
。


24. 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
 ②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用 (填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定 管 ,理由是
|
(3)能否用水代替苯 ,理由是
。
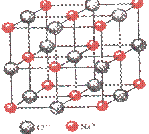
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。
23.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为( )
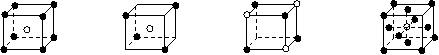
A B C D
22. 有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是( )
有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是( )
A.它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B.它们的原子半径依次增大;
 C.它们的单质在常温.常压下的密度依次减小
C.它们的单质在常温.常压下的密度依次减小
D.它们的最高价氧化物的水化物都是强电解质
21.某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是( )
A.氧元素的相对原子质量为12a/b
B.1mol该原子质量为aNAg
C.x g该氧原子所含的电子数为8x/a
D.y g 该氧原子的中子数一定为8y/a
20. A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物;
C.B的氧化物熔点比A的氧化物高; D.A与C可形成离子化合物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com