
题目列表(包括答案和解析)
22.(1)1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 (2分)
(2)配位键(1分)
CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)(2分)
 (3)① 结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4 ;( 3分)NH3分子间还存在氢键作用,因此NH3的沸点高于PH3。( 2分)
(3)① 结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4 ;( 3分)NH3分子间还存在氢键作用,因此NH3的沸点高于PH3。( 2分)
② C-H键键能大于Si-H键,因此CH4分解温度高于SiH4;N-H键键能大于P-H键,因此NH3分解温度高于PH3。 ( 2分)
21.(10分)(1)棕色( 1分) 紫色( 1分) 温度高时,分子间作用力弱 ( 2分)
 (2)这是因为水晶是晶体,在导热性中体现了各向异性,即水晶柱面不同方向的导热性不同,故融化的石蜡呈椭圆形。( 3分)而玻璃是非晶体,不具有各向异性,玻璃的各个方向的导热性都是相同的,故熔化的石蜡呈圆形。(3分)
(2)这是因为水晶是晶体,在导热性中体现了各向异性,即水晶柱面不同方向的导热性不同,故融化的石蜡呈椭圆形。( 3分)而玻璃是非晶体,不具有各向异性,玻璃的各个方向的导热性都是相同的,故熔化的石蜡呈圆形。(3分)
20.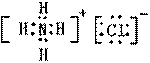 (18分)(1)NH3 三角锥形
(2)极性 非极性
(18分)(1)NH3 三角锥形
(2)极性 非极性
 (3)三 ⅥA
(4)
离子 (每空2分)
(3)三 ⅥA
(4)
离子 (每空2分)
19.(6分)1s22s22p63s23p4 S H2SO4 (每空2分)
10.C 11.AC 12.B 13.AC 14.D 15.CD 16D 17C 18AD
第Ⅱ卷(共46分)
1.C 2.B 3.C 4.D 5.B 6.A 7.B 8.B 9.A
22. (10分)氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(10分)氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是
_______________________________________________________________________。
 (4)已知:
(4)已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是_________________________
____________________________________________________________________________________________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______________________
_____________________________________________________________________________________________________________________________________________。
试题答案及评分标准
第Ⅰ卷(共54分)
21.(10分)(1)碘在不同溶剂中呈现紫色、棕色……一般认为溶液呈紫色的表明溶解了的“碘分子”并未和溶剂发生很强的结合。已知不同温度下,碘在石蜡油中的溶液呈紫色或棕色。请回答:温度低时溶液呈 色,温度高时溶液呈 色,因为 。
(2)在水晶的柱面上涂一层石蜡,用红热的针接触面中央,石蜡熔化后呈椭圆形;用玻璃代替水晶重复上述操作,熔化的石蜡则呈圆形。试用你所学过关于晶体性质的知识解释上述现象。
20.(18分)m、n、x、y四种主族元素在周期表里的相对位置如下图所示。
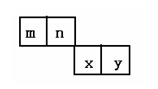 已知它们的原子序数总和为46,则:
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的分子式为 ,空间构型为 。
(2)m与y所形成的化合物含 键,属 分子。(填“极性”或“非极性”)
(3)x位于周期表的第 周期,第 族;其原子结构示意图为 。
(4)由n、y的氢化物相互作用所生成的物质的电子式为 ,此物质在固态时属于 晶体。
19.(8分)某元素的激发态原子的电子排布式为1s 2s
2s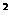 2p
2p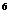 3s
3s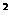 3p
3p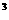 4s
4s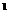 ,则该元素基态原子的电子排布式为 ;元素符号为
;其最高价氧化物对应的水化物的化学式是
。
,则该元素基态原子的电子排布式为 ;元素符号为
;其最高价氧化物对应的水化物的化学式是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com