
题目列表(包括答案和解析)
7.Fe3+、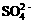 、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,
、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,
X可能是
 A.Na+
B.OH–
C.
A.Na+
B.OH–
C.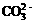 D.Cl–
D.Cl–
6.下列叙述正确的是
A.任何晶体中,若含有阳离子也一定含有阴离子
B.原子晶体中只含有共价键
C.离子晶体中只含有离子键
D.分子晶体中只存在分子间作用力,不含化学键
5.下列说法正确的是
A.在Na2O2晶体中阳离子与阴离子的物质的量之比为l:1
B.离子晶体中一定含有金属阳离子
C.水加热到很高的温度都难以分解是因为水分子间存在氢键
D.用鸡蛋壳内膜和蒸馏水除去淀粉胶体中的食盐
4.2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。三聚氰胺的分子式为C3N3(NH2)3, 在一般情况下较稳定,但在高温下可能会分解放出氰化物。下列有关三聚氰胺的说法不正确的是
A.三聚氰胺的摩尔质量为126
B.用三聚氰胺制造的餐具不可以放进微波炉中加热使用
C.三聚氰胺中C、N两种元素的质量比为3:7
D.三聚氰胺中氮元素的质量分数约为66.7%
3.下列关于物质性质的比较,正确的是
A.NaF、NaCl、NaBr、NaI的熔点依次升高 B.熔点:铯>钾>钠>钠和钾的合金
C.熔沸点:HI>HBr>HCl>HF D.热稳定性:HF>HCl>HBr>HI
2.2008年诺贝尔化学奖授予钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白(一种蛋白质,简称GFP)方面做出的杰出贡献。下列有关GFP的说法错误的是
 A.属于高分子化合物
B.遇到CuSO4溶液会发生盐析
A.属于高分子化合物
B.遇到CuSO4溶液会发生盐析
C.水解后可得到多种氨基酸 D.可用于蛋白质反应机理的研究
1.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质:①是溶液,②是胶体,③能产生丁达尔效应,④能透过滤纸,⑤能透过半透膜,⑥静置后,会析出黑色沉淀,叙述正确的是
A.①④⑥ B. ②③⑤ C.②③④ D.①③④⑥
23. (16分)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料。已知CuSO4·5H2O的部分结构可表示如下:
(16分)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料。已知CuSO4·5H2O的部分结构可表示如下:
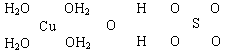
(1)写出铜原子价电子层的电子排布式____________,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有__________(填元素符号)。
(2)请在上图中把CuSO4·5H2O结构中的化学键用短线“--”表示出来。
 (3)往浓CuSO4溶液中加入过量较浓的NH3·H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层,静置。经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是______________________________________________。
(3)往浓CuSO4溶液中加入过量较浓的NH3·H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层,静置。经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是______________________________________________。
(4)Cu(NH3)4SO4·H2O晶体中呈正四面体的原子团是______________,杂化轨道类型是sp3的原子是____________________________。
(5)如将深蓝色溶液加热,可能得到什么结果?________________________________。
⑹把CoCl2溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)___________,此配合物中的Co化合价为__ ____。
22.(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ. 二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
 A.苯与B3N3H6互为等电子体
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
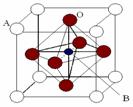
Ⅱ. 2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
⑶Mn的外围电子轨道表示式为: 。
⑷下列有关说法正确的是 。
 A.镧、锰、氧分别位于周期表f、d、p区
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
21.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
 460 460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
 请在立方体的顶点用“●”表示出与之紧邻的硅原子。
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com