
题目列表(包括答案和解析)
17.(3分)下列实验操作或对实验事实的描述不正确的是 (填序号)
A.用分液漏斗进行分液操作,将甘油和水的混合物分离; B.从溴的四氯化碳溶液中提取溴,可用苯进行萃取; C.用热的浓HCl洗涤附着有MnO2的试管; D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ; E.用碱式滴定管量得KMnO4溶液20.50mL ; F.实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;G.只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别; H.用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管末端应插入FeSO4溶液液面之下.
16. 已知 I-、Fe2+、SO 2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为
Cl-< Fe 2+< H2O 2 < I-< SO 2,则下列反应不能发生的是
A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B、I2+SO2+2H2O=H2SO4+2HI
C、H2O2+H2SO4=SO2+O2+2H2O D、2Fe3++2I-=2Fe2++I2
第II卷(非选择题 共52分)
15.一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g ) △H=-574 kJ·mol-1
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g ) △H=-1160 kJ·mol一1。
下列正确的选项是
A.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
B.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O(l) △H=-867 kJ·mol-1
C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol
D.若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为3.2 mol
14.
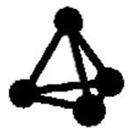 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N-N吸收167 kJ热量,生成1 mol
N
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N-N吸收167 kJ热量,生成1 mol
N N放出942 kJ热量,根据以上信息和数据,下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1 mol N4气体转变为N2将吸收882 kJ热量
13.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法不正确的是
A.若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X
B.若8>m>3,则X必定为主族元素
 C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D.若a =b=3,8>m>n>b,则元素非金属性:X>Y
12.下列叙述正确的是
A.直径介于1 nm ~ 100 nm之间的微粒称为胶体
B.电泳现象可证明胶体带电
C.用盐析法可分离皂化反应后所得的产物
D.用含1 mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子
11.下列性质既可能是胶体所具有,也可能是溶液所具有的是
A.光线照射时,从侧面可观察到一条光亮的通路
B.加入稀硫酸立即产生沉淀 C.分散质粒子小于1nm
D.装入半透膜袋中并将其浸入盛水的烧杯中一段时间,袋内外均含分散质粒子
10.下列离子方程式正确的是
A.足量氯气通入溴化亚铁溶液中:2Fe2++Cl2====2Cl-+2Fe3+
B.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+ OH-==CO32- + H2O
C.氨水中加入少量氯化铝溶液 Al3+ + 4OH- = AlO2- + 2H2O
D.H2S通入FeCl3溶液中:H2S+2Fe3+====2Fe2++S↓+2H+
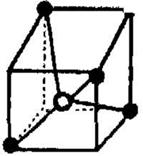
9.常见的离子晶体类型有多种,如右图是其中一种空间构型,
 则该晶体中X、Y的离子个数之比可能为
则该晶体中X、Y的离子个数之比可能为
A.YX4
B.YX2
 C.YX D.XY4
C.YX D.XY4
8. 下列各组离子能在指定溶液中,大量共存的是
下列各组离子能在指定溶液中,大量共存的是
①含有大量AlO2-的溶液:Al3+、SO42-、ClO-、Na+
②使pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③由水电离的H+浓度c(H+)=1×10-13mol/L的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使甲基橙变红的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42-
⑥酸性溶液中:Fe2+,Al3+,NO3-,I-,S2-
 A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com