
题目列表(包括答案和解析)
5.能用键能知识加以解释的是
A.稀有气体的化学性质很不活泼 B.HCl气体比HI气体稳定
C.干冰易升华 D.氮气的化学性质很稳定
4.下列说法中,错误的是
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
3.下列分子中存在π键的是
A.H2 B.Cl2 C.N2 D.HCl
2.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl C.Cl2 D.F2
1. 对δ键的认识不正确的是
对δ键的认识不正确的是
A.σ键不属于共价键,是另一种化学键
B.s-s σ键与s-p σ键的对称性相同
 C.分子中含有共价键,则至少含有一个σ键
C.分子中含有共价键,则至少含有一个σ键
D.含有π键的化合物与只含σ键的化合物的化学性质不同
22.(14分)A为含有C、H、O三元素的芳香烃的衍生物,各物质间的相互关系如下图。又
已知:ROH+HX RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H15O6Na;
RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H15O6Na;
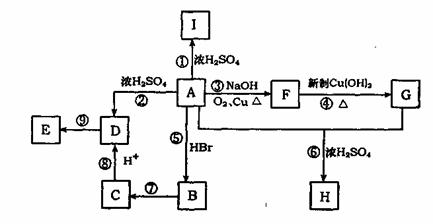 I中含有一个苯环,还含有一个六元杂环。
I中含有一个苯环,还含有一个六元杂环。
回答下列问题:
(1)写出A的分子式 。I的结构简式 ;
(2)写出有关反应的反应类型:反应②为 ,反应⑤为:
(3)D中所含官能团的名称是 ;
(4)写出反应④的化学方程式 ;
写出反应⑦的化学方程式 ;
(5)A的同分异构体有多种,写出符合下列条件的A的两种同分异构体的结构简式。
 ①A分子中有两个对位取代基;
①A分子中有两个对位取代基;
②与FeCl3溶液能发生显色反应;
③能发生银镜反应。
和 。

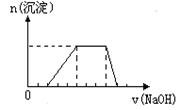
21. (6分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
(由少到多排列),且各离子的物质的量之比为
;肯定不含的阳离子是_______________
(6分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
(由少到多排列),且各离子的物质的量之比为
;肯定不含的阳离子是_______________

20.(12分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3) 写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
19.(12分)根据以下化学反应方程式回答问题:
(1)(4分)已知反应3S+6KOH
 2K2S+K2SO3+3H2O,①还原剂 ,还原产物 。
2K2S+K2SO3+3H2O,①还原剂 ,还原产物 。
②请用双线桥法标明上述化学方程式中电子转移的方向和数目 。
(2)(4分)已知反应KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
①当有1mol I2生成时,有 mol还原剂被氧化。
②当有1mol氧化剂参与反应时,转移电子的物质的量为 mol。
(3) (4分)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2
|
|
错误观点 |
离子方程式 |
|
① |
所有的离子方程式均可以表示一类反应 |
|
|
② |
所有酸碱中和反应均可表示为: H++OH-=H2O |
|
18.(5分)按如下实验操作步骤制备Fe(OH)3胶体:
 (1)用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾
(1)用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾
(2)向烧杯中逐滴加入饱和FeCl3溶液
(3)继续煮沸至液体是透明的红褐色,即得到Fe(OH)3胶体。
回答下列问题:
 (1)写出制备Fe(OH)3胶体的化学方程式:__________________________ ;
(1)写出制备Fe(OH)3胶体的化学方程式:__________________________ ;
(2)某同学决定对制备的胶体进行提纯,他将进行的操作名称是?___ ;
(3)若向Fe(OH)3胶体中滴加稀硫酸可能会出现的现象:_________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com