
题目列表(包括答案和解析)
3.
 下列措施或事实能用勒沙特列原理解释的是
下列措施或事实能用勒沙特列原理解释的是
 A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
 B.H2、I2、HI三者的平衡混合气加压后颜色变深
B.H2、I2、HI三者的平衡混合气加压后颜色变深

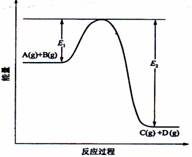 C.钢铁在潮湿的空气中更容易生锈
C.钢铁在潮湿的空气中更容易生锈
 D.含有酚酞的氨水中加入少量的氯化铵溶液的颜色变浅
D.含有酚酞的氨水中加入少量的氯化铵溶液的颜色变浅
2. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
 A.酸碱中和时的反应热:H+(aq)+OH-(aq)=H2O(l); △H= + 57.3 kJ·mol-1
A.酸碱中和时的反应热:H+(aq)+OH-(aq)=H2O(l); △H= + 57.3 kJ·mol-1
 B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
 C.明矾水解的离子方程式:
Al3++3 H2O===Al(OH)3 ↓+3H+
C.明矾水解的离子方程式:
Al3++3 H2O===Al(OH)3 ↓+3H+

 D.醋酸溶于水的电离方程式:CH3COOH+H2O CH3COO-+H3O+
D.醋酸溶于水的电离方程式:CH3COOH+H2O CH3COO-+H3O+
1. 把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化最小的是
把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化最小的是
 A.自来水 B.0.5摩/升盐酸 C.0.5摩/升醋酸 D.0.5摩/升氯化铵溶液
A.自来水 B.0.5摩/升盐酸 C.0.5摩/升醋酸 D.0.5摩/升氯化铵溶液
21.(11分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为______________________________;
(2)写出与H2O分子互为等电子体的微粒(原子个数及电子总数相同) 。(写一个即可)
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氢、氧原子间的化学键类型发生了改变
B.微粒的形状发生了改变
C.水分子仍保留它的化学性质
D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________________________(请用相应的编号填写)
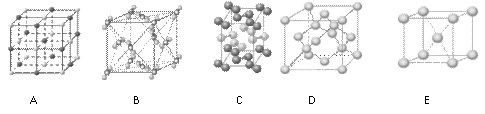
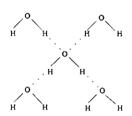 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是____________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是____________kJ/mol;
20.(12分)1183 K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
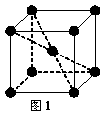
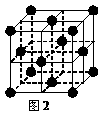
(1)铁原子的简化电子排布式为 ;铁晶体中铁原子以 键相互结合。
(2)在1183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为 个;
(3)纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1183 K以下与1183 K以上之比)_______________ 。(若遇根号,不必运算,下同。)
(4)转变温度前后两者的密度比(1183 K以下与1183 K以上之比)_______________。
18.(8分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);

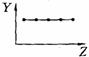
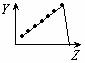
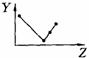
A B C D
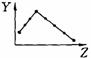
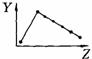


E F G H
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数 ( )(2)ⅦA族元素氢化物的沸点 ( )
(3)第三周期元素单质的熔点 ( )(4)第三周期元素的最高正化合价 ( )
(5)IA族元素单质熔点 ( )(6)F-、Na+、Mg2+、Al3+四种离子的离子半径( )
(7)部分短周期元素的原子半径( )(8)短周期元素的第一电离能 ( )
17.(7分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
|
X |
L层中p电子数比s电子数多2个 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
L层有三个未成对电子 |
(1)元素X的原子最外层共有 种不同运动状态的电子。元素X的外围轨道表示式为 。
(2)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 ;
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(3)探寻物质的性质差异性是学习的重要方法之-。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
16.(8分)25Mn、26Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ;
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 晶体;
(3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。 面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为
。
面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为
。
15. (10分)下图是11Na、29Cu、14Si、1H、6C、7N等元素形成单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(10分)下图是11Na、29Cu、14Si、1H、6C、7N等元素形成单质的熔点高低的顺序,其中c、d均是热和电的良导体。
 (1)请写出图中d单质对应元素原子基态时的电子排布式
。
(1)请写出图中d单质对应元素原子基态时的电子排布式
。

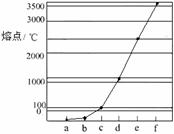
(2)单质a、f、b对应的元素以原子个数比1∶1∶1形成的分子中含 个σ键, 个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成含d元素的离子(d离子与X以1∶4结合),推测X与d的高价离子之间是以 键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为: ,该含氧酸的分子式为: ,请简要说明该物质易溶于水的原因
。
,该含氧酸的分子式为: ,请简要说明该物质易溶于水的原因
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com