
题目列表(包括答案和解析)
13. 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
 A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
12. 现有常温下的四种溶液(如下表),下列有关说法不正确的是
现有常温下的四种溶液(如下表),下列有关说法不正确的是

|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
硫酸 |
|
pH |
11 |
11 |
3 |
3 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
 B.分别加水稀释10倍,四种溶液的pH大小关系是:②>①>④>③
B.分别加水稀释10倍,四种溶液的pH大小关系是:②>①>④>③
 C.①、④两溶液混合后,若溶液呈中性,则所得溶液中c(NH4+)<c(SO42-)
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中c(NH4+)<c(SO42-)
 D.V1 L④与V2 L②溶液混合后,若混合后溶液pH=4,则V1∶V2= 11∶9
D.V1 L④与V2 L②溶液混合后,若混合后溶液pH=4,则V1∶V2= 11∶9
11. 一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
 A.以X的反应速率为0.001 mol·L-1·s-1
A.以X的反应速率为0.001 mol·L-1·s-1
 B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
 C.若增大压强,则物质Y的转化率减小
C.若增大压强,则物质Y的转化率减小
 D.若升高温度,X的体积分数增大,则该反应的ΔH>0
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
10. 在25℃时,水的电离达到平衡:H2O
在25℃时,水的电离达到平衡:H2O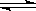 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
 A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
 B.向水中加入少量固体硫酸酸氢钠,c(H+)增大,Kw不变
B.向水中加入少量固体硫酸酸氢钠,c(H+)增大,Kw不变
 C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低
 D.将水加热,Kw增大,溶液仍为中性,pH不变
D.将水加热,Kw增大,溶液仍为中性,pH不变
9. 下列各环境下的离子组合一定能大量共存的是
下列各环境下的离子组合一定能大量共存的是
 A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
 B.某溶液中: Al3+、NH4+、SO42―、HCO3 ―
B.某溶液中: Al3+、NH4+、SO42―、HCO3 ―
 C.c(H+)=10-14 mol/L的溶液中:Na+、AlO2-、S2-、SO32-
C.c(H+)=10-14 mol/L的溶液中:Na+、AlO2-、S2-、SO32-
 D.由水电离出的c(H+)=1×10-14mol/L的溶液中:Na+、CO32-、Cl-、K+、
D.由水电离出的c(H+)=1×10-14mol/L的溶液中:Na+、CO32-、Cl-、K+、
8. 阿伏加德罗常数为NA ,下列叙述中,正确的是
阿伏加德罗常数为NA ,下列叙述中,正确的是
 A.同温时,1L 0.5 mol / L NH4Cl溶液与2L 0.25 mol / L NH4Cl溶液所含NH4+物质的量不同
A.同温时,1L 0.5 mol / L NH4Cl溶液与2L 0.25 mol / L NH4Cl溶液所含NH4+物质的量不同
 B.含0.1 mol H2O2的水溶液跟Mn02充分作用,反应过程中转移的电子总数0.2NA
B.含0.1 mol H2O2的水溶液跟Mn02充分作用,反应过程中转移的电子总数0.2NA
 C.0.1L 2 mol / L的碳酸钠溶液所含CO32-离子的总数为0.2NA
C.0.1L 2 mol / L的碳酸钠溶液所含CO32-离子的总数为0.2NA
 D.1L 0.5 mol / L的蔗糖溶液中含有的分子总数为0.5NA
D.1L 0.5 mol / L的蔗糖溶液中含有的分子总数为0.5NA
7. 用0.1mol/L盐酸分别与25mlNaOH溶液和25ml氨水完全反应,都消耗了25ml盐酸,这表明NaOH溶液和氨水的关系是
用0.1mol/L盐酸分别与25mlNaOH溶液和25ml氨水完全反应,都消耗了25ml盐酸,这表明NaOH溶液和氨水的关系是
 A.PH相同 B.物质的量浓度相同
A.PH相同 B.物质的量浓度相同
 C.电离平衡常数相同 D.反应后所得溶液的PH相同
C.电离平衡常数相同 D.反应后所得溶液的PH相同
6. 下列有关叙述正确的是
下列有关叙述正确的是
 A.将AlCl3溶液加蒸干制得无水AlCl3
A.将AlCl3溶液加蒸干制得无水AlCl3
 B.输油管道为了防止表面被腐蚀应涂上隔水材料并与电源的正极相连
B.输油管道为了防止表面被腐蚀应涂上隔水材料并与电源的正极相连
 C.pH=9的NaOH溶液和Na2CO3溶液,两溶液中OH―离子浓度不同
C.pH=9的NaOH溶液和Na2CO3溶液,两溶液中OH―离子浓度不同
 D. 配制FeCl2溶液时,可将FeCl2固体溶于盐酸,再加水稀释和少量的铁屑保存
D. 配制FeCl2溶液时,可将FeCl2固体溶于盐酸,再加水稀释和少量的铁屑保存
5. 在H2S的饱和溶液中存在下列平衡①H2S
在H2S的饱和溶液中存在下列平衡①H2S 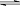 H++HS-
②HS-
H++HS-
②HS- 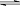 H++S2-,下列哪种措施,既可增大c(S2-),又能提高pH,又可减小H2S的电离程度的是
H++S2-,下列哪种措施,既可增大c(S2-),又能提高pH,又可减小H2S的电离程度的是
 A.加NaOH B.通入H2S气体 C.降温 D.加入Na2S晶体
A.加NaOH B.通入H2S气体 C.降温 D.加入Na2S晶体
4. 反应A(g)+B(g)
反应A(g)+B(g) C(g)
+D(g)过程中的能量变化如图所示,下列叙述中正确的是
C(g)
+D(g)过程中的能量变化如图所示,下列叙述中正确的是
 A.该反应是吸热反应
A.该反应是吸热反应
 B.当反应达到平衡时,升高温度,A的转化率增大
B.当反应达到平衡时,升高温度,A的转化率增大
 C.反应体系中加入催化剂对反应热没有影响
C.反应体系中加入催化剂对反应热没有影响
 D.在反应体系中加催化剂,反应速率增大,E1减小E2增大
D.在反应体系中加催化剂,反应速率增大,E1减小E2增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com