
题目列表(包括答案和解析)
3.在一定温度下的密闭容器中,当下列物理量不再变化时,表明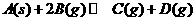 已达平衡的是
已达平衡的是
A、混合气体的压强 B、混合气体的密度
C、混合气体的分子数目 D、混合气体的总质量的量
2.以下反应可以用 判断来解释的是
 A 硝酸铵自发地溶于水
A 硝酸铵自发地溶于水
B CaO(s)+CO2==CaCO3(s) △H=-175.7KJ/mol
C NH4HCO3(S)+NH3(g)==(NH4)2CO3(S) △H=-74.9KJ/mol
D 2H2(g)+O2(g)==2H2O(I) △H=-285.8kJ/mol
1.反应H2(g)+I2(g)  2HI(g)的平衡常数为K1;.反应HI(g)
2HI(g)的平衡常数为K1;.反应HI(g)  1/2H2(g)+l/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
1/2H2(g)+l/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
A.K1=2K2 B.K1=K22 C.K1=1/ K22 D.K1-=2K2
23.在100mL稀硫酸和稀盐酸的混合溶液中加入3.42g氢氧化钡,充分反应后,过滤、干燥得沉淀2.33g,经测定滤液pH=13。试求原混合溶液中硫酸和盐酸的物质的量浓度分别是多少?
22.(12分)(1)图A是某短周期元素M的部分电离能变化情况。M元素位于周期表的第 族。
 (2)图B是部分同主族元素氢化物沸点的变化规律图像。两位同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是
(填“a”或“b”),理由
。
(2)图B是部分同主族元素氢化物沸点的变化规律图像。两位同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是
(填“a”或“b”),理由
。
A B
(3)甲、乙两种氢化物分子中,中心原子的轨道杂化方式相同,但甲、乙两分子的立体结构不同,原因是 。
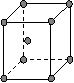
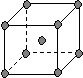
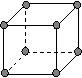 (4)下图是常见金属晶体的四种堆积模型:
(4)下图是常见金属晶体的四种堆积模型:
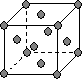
A B C D
(简单立方) (体心立方) (ABAB型) (ABCABC型)
请判断下列四种金属晶体分别对应的堆积模型:(填序号)
Po K Mg Cu
21.
 (10分)现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如右图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应,同时产生一种能与人体内血红蛋白结合而使人中毒的物质。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
(10分)现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如右图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应,同时产生一种能与人体内血红蛋白结合而使人中毒的物质。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式___________________;与A同主族的第四周期元素基态原子的电子排布式为 ;
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序 (用元素符号回答);
(3)上述六种物质或粒子中互为等电子体的是 (写出化学式);
(4)F易溶于E,其原因是 。
20.(12分)盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式
。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式
。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
|
难溶电解质 |
Cu(OH)2 |
CuS |
Pb(OH)2 |
PbS |
|
Ksp |
4.8×10-20 |
6.3×10-36 |
1.2×10-15 |
1.0×10-28 |
 (3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
 ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
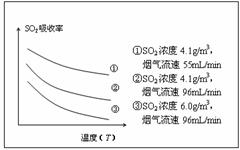
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
19.(20分)(1)对下列有机物进行分类(填序号)。
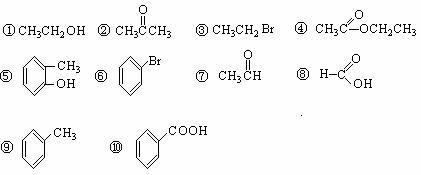
①芳香烃: ;②卤代烃: ;③醇: ;
④醛: ;⑤羧酸: ;⑥酯: 。
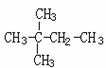 (2)
的系统命名是:______________________ ;它的核磁共振氢谱
(2)
的系统命名是:______________________ ;它的核磁共振氢谱
中有______个峰,峰的面积比为___________;
(3)3-甲基-2-戊烯的结构简式是_________________ _ 。
18.(16分)填写下列表格:
|
分子 |
中心原子杂化类型 |
分子或离子立体结构 |
|
H2O |
|
|
|
C2H2 |
|
|
|
NH3 |
|
|
|
SO42- |
|
|
17. (8分)下列实验操作或对实验事实的叙述不正确的是
(填序号)。
(8分)下列实验操作或对实验事实的叙述不正确的是
(填序号)。
 ① 用分液漏斗分离乙醇和四氯化碳的混合物;
① 用分液漏斗分离乙醇和四氯化碳的混合物;
 ② 用过滤的方法从溴水中将溴分离出来;
② 用过滤的方法从溴水中将溴分离出来;
 ③ 用质谱仪测定出乙醇的相对分子质量为46;
③ 用质谱仪测定出乙醇的相对分子质量为46;
④ 用酸式滴定管量取25.00 mL 1 mol·L-1的酸性高锰酸钾溶液;
⑤ 为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用;
 ⑥ 配制FeSO4溶液时,需加入少量铁粉和稀硫酸;
⑥ 配制FeSO4溶液时,需加入少量铁粉和稀硫酸;
⑦ 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com