
题目列表(包括答案和解析)
4.联合制碱法的发明人是中国的科学家 ( )
A.华罗庚 B.钱学森 C.侯德榜 D.钱三强
答案:C
3、合成氨工业上采用循环操作的主要是因为( )
A.加快反应速率
B. 能提高NH3的平衡浓度
C. 降低NH3的沸点
D.提高N2和H2的利用率
答案:D
2.下列物质不属于“城市空气质量日报”报导的是 ( )
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
1.飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是 ( )
①氧化剂 ②还原剂 ③催化剂 ④吸附剂
A.①② B.① C.①③ D.③④
答案:D
25、某硫酸厂初步处理后的尾气中含0.2% 的SO2和10% 的O2(均为体积分数)。为了进一步除去SO2,并将SO2转变为(NH4)2SO4,有人设计了如下方案:在400℃时,尾气以5 m3/h的速率通过V2O5的催化剂层后,与20 L/h速率的氨气混合喷水。此时气体温度由400℃降至200℃,在热的结晶装置中得到(NH4)2SO4晶体(气体的体积已转为标准状况)。请回答下列问题:
⑴ 按反应中的理论值,SO2和O2的体积比为2/1,但实际生产中这个比值是多少?为什么?
⑵ 通过计算说明为什么尾气以5 m3/h的速率与20 L/h速率的氨气混合?
⑶ 若该厂每天排放10 000 m3尾气,求该厂每月(按30天计算)可得到(NH4)2SO4的质量为多少?


24.形成酸雨的原理之一可简示如下:
|
|
|
|
|
|
 A
A  B
B  硫酸。回答下列问题:
硫酸。回答下列问题:
(1)A物质的化学式____________,B物质的化学式_______________
(2)三个反应中不属于氧化还原反应的是_________________________(填序号)。
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的____________________(填氧化剂或还原剂)除去SO2,达到减小污染的目的。
(4)从环境保护的角度认为:雨水的pH<5.6时,就判断为酸雨,已知pH=-lgc(H+),经测定某次雨水中只含硫酸,且浓度为5×10-5mol/L,这次降雨________(填是或不是)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明:高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%。但由于建造高烟囱的结果,地面浓度降低了30%之多。
(I)你认为减少酸雨产生的途径可采取的措施是________。
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫
D.把工厂迁移到农村 E.开发新能源
(Ⅱ)请从全球环境保护的角度,分析这种建造高烟囱的方法是否可取__________,理由是______________________________·
答案: (1)SO2,SO3 (2)③;(3)还原剂 (4) 是 (5)(I)A、C、E (II)不可取;高烟囱并没有降低大气中的SO2的含量,随着雨水仍会降落地面。
23、(4分)在硫酸工业生产过程中,有反应 (正反应为放热反应),根据表所提供的不同压强下SO2转化率(%)的数据,
(正反应为放热反应),根据表所提供的不同压强下SO2转化率(%)的数据,
 |
1× 105Pa |
5× 105Pa |
10× 105Pa |
50× 105Pa |
100× 105Pa |
|
450℃ |
97.5 |
98.9 |
99.2 |
99.6 |
99.7 |
|
500℃ |
85.6 |
92.9 |
94.9 |
97.7 |
98.3 |
试选择该反应的适宜条件(以V2O5)作催化剂) 、 。
答案:450℃;1×105Pa。
22、(07高考·海南)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
答案:(1)2NH4Cl +(OH)2 CaCl2 +2NH3↑+2H2O
(2)NH3 +H2O +CO2 +NaCl=NaHCO3↓+ NH4Cl
2NaHCO3 Na2CO3 +CO2↑+H2O
(3)前者的CO2 来自合成氨厂,后者的CO2 来自煅烧石灰石。
(4)原子利用率(%)= =
= ×100%
×100%
21.某空气污染监测仪是根据SO2与Br2水的定量反应来测定空气中的SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解槽阳极的氧化反应,电解槽的阳极室与阴极室是隔开的。当测量某地区空气中二氧化硫的含量时,空气(已除尘)以1.5×10-4m3·min-1的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10-11mol·.S-1,此条件下能够保持电解槽中Br2浓度恒定并恰好与二氧化硫完全反应(设空气中不含能与溴反应的其他杂质)。
(1)写出此监测过程中发生反应的化学方程式______________________________________
(2)该地区空气中二氧化硫的含量(单位g/m3空气)为____________________________。
答案.(1)2KBr+2H2O 2KOH十H2↑+Br2 、Br2+SO2+2H2O===H2SO4+2HBr
2KOH十H2↑+Br2 、Br2+SO2+2H2O===H2SO4+2HBr
(2)1.1×10-3g/m3空气
98.3%;防止形成酸雾,有利于 的吸收;
的吸收; 等;
等;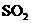 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com