
题目列表(包括答案和解析)
26、(7分)将1体积N2和4体积H2放入密闭容器中,测得压强为3.03×105Pa,达平衡后测得含NH3为12%,试求:
(1)平衡时N2和H2占平衡混合气体的体积百分比;
(2)到达平衡时的压强。
解析:在相同条件下,气体的体积比等于物质的量比,假定N2和H2的起始物质的量分别为1mol和4mol,由达平衡时氨的百分含量可求出NH3平衡时的物质的量,再求出平衡时气体的总物质的量,即可求出N2和H2的百分含量。
设到达平衡时NH3的物质的量为x.
N2 + 3H2  2NH3
2NH3
起始 1mol 4mol 0
转化 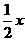
 x
x
平衡 1mol-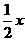 4mol-
4mol- x
x
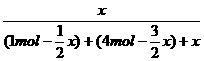 ×100%=12%
×100%=12%
平衡时的总物质的量为1mol-
 mol=4.46mol。
mol=4.46mol。
N2的百分含量: ×100%=16.4mol。
×100%=16.4mol。
H2的百分含量:1-16.4%-12%=71.6%。
平衡混合气的压强为 ,
,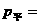 2.70×105Pa。
2.70×105Pa。
25.(8分)工厂的工业废水,不可直接往江河排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、
OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_____________________________________。
(2)乙厂污水中含有的四种离子可能是:_____________________________________。
(3)乙厂进行废水处理,方法之一,可往废水中加入一定量的_______________(选填;活性炭、硫酸亚铁、铁粉),可以回收其中的金属___________________(填元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水中的___________(填离子符号)转化为沉淀,再排放则大大降低污染程度。过滤,所得废水主要含_______________________,可用于浇灌农田。
答案:(1)OH-、Cl-、SO42-、K+ (2)Fe3+、Ba2+、Ag+、NO3- (3)铁粉,Ag
(4)OH-、Fe3+、Cl-、Ag+、SO42-、Ba2+,KNO3
24、(4分)向饱和的Na2CO3溶液中通入过量的CO2气体,现象是______________________,产生此现象的原因是___________________________________.
答案:有晶体析出;Na2CO3+CO2+H2O=2NaHCO3 且NaHCO3比Na2CO3溶解度小
23、我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
答案
(1) 联合制碱法或侯德榜制碱法 化肥或电解液或焊药等(其他合理答案均给分)
(2) NH3 + CO2 + H2O + NaCl → NH4Cl + NaHCO3↓
或 NH3 + CO2 + H2O → NH4HCO3 NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
(3) CO2
(4) I 过滤
稀硝酸和硝酸银溶液 (6) a、c
22、(9分)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡.
NH3+H2O  NH3·H2O
NH3·H2O  NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度__________,
NH4+的浓度_____。
(2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有
___________、___________、___________。
(3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 __________。
答案:⑴右;减小;增大
⑵右;OH-;NH3•H2O;NH3
⑶左;NaOH固体溶解,溶液中产生气泡
21、(4分)工业上用氨和二氧化碳反应合成尿素,其反应是:CO2+2NH3=CO(NH2)2+H2O。已知下列物质在一定条件下均能与水反应产生H2和CO2。H2是合成氨的原料,CO2供合成尿素用。(1)若从充分利用原料的角度考虑,选用 (填序号)作原料较好。
A. CO B. 石脑油(C5H12、C6H14) C. CH4 D. 焦炭
(2)作出这种选择的依据是 。
注:有关的反应如下:① C+2H2O=CO2+2H2 ② CO+H2O=CO2+H2
③ CH4+2H2O=CO2+4H2 ④ C5H12+10H2O=5CO2+16
答案:(1)B (2) 根据反应N2+3H2=2NH3和CO2+2NH3=CO(NH2)2+H2O,若要充分利用原料,显然要求原料与水反应产生的H2和CO2的物质的量之比等于或接近于3∶1时,上述反应趋于恰好完全反应,原料得以充分利用。根据题示信息,上求有关化学方程式中,H2和CO2的物质的量之比:为2∶1,为1∶1,为4∶1,为32∶1。故石脑油的利用率最高。
19(7分)、已知N (g)+3H
(g)+3H (g)
(g) 2NH
2NH (g)
(g) 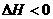 ,
,
2SO (g)+O
(g)+O (g)
(g) 2 SO
2 SO (g)
(g) 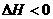 。回答下列问题:
。回答下列问题:
(1)从影响速率和平衡的因素分析,要有利于NH 和SO
和SO 的生成,理论上应采取的措施是_______________,实际生产中采取的措施分别是_____________、________________。
的生成,理论上应采取的措施是_______________,实际生产中采取的措施分别是_____________、________________。
(2)在实际生产合成氨过程,要分离出氨气,目的是_____________;而合成SO 过程中,不需要分离出SO
过程中,不需要分离出SO ,原因是_____________。
,原因是_____________。
答案:(1)高温、高压、催化剂;合成氨中,适宜的温度、高压、催化剂;合成SO 中,高温、常压、催化剂。
中,高温、常压、催化剂。
(2)减小生成物浓度,使平衡向生成NH 的方向移动;该反应向SO
的方向移动;该反应向SO 生成的方向进行程度大,达到平衡后SO
生成的方向进行程度大,达到平衡后SO 余量较少,故不需要分离SO
余量较少,故不需要分离SO 。
。
20.除去下列溶液中混有的少量杂质(括号内的物质),应加入什么试剂?写出有关反应的离子方程式.
(1)NaOH (Na2CO3)
(2)NaNO3 (NaCl)
(3)Na2CO3 (NaHCO3)
答案: (1)Ca(OH)2 Ca2++CO32=CaCO3↓
(2)AgNO3 Ag+ + Cl-=AgCl↓
(3)NaOH HCO3-+OH-=CO32-+H2O
18、在一定温度和压强下,合成氨反应达到平衡时,下列操作平衡不发生移动的是( )
A、恒温、恒压时充入氨气 B、恒温、恒容时充入氮气
C、恒温、恒容时充入氦气 D、恒温、恒压时充入氦气
答案:C
解析:化学平衡能否移动,要看达到后所改变的外部条件,是否造成υ正与υ逆不相等的结果,如果能,则平衡一定能发生移动。选项A中恒温、恒压时充入氨气,体积必然扩大,,相当于降低了反应物浓度,平衡将会逆向移动。选项B中恒温、恒容时充入氮气,增大反应物浓度,故平衡正向移动。选项C中恒温、恒容时充入氦气,虽然使体系的压强增大了,但由于恒容条件下充入氦气对反应体系中物质浓度都没有影响,故平衡仍然不移动。选项D 中恒压条件下充入氦气,体积改变了,各物质浓度发生了变化,故平衡要逆向移动。
17、合成氨的温度和压强通常控制在约500
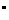 C以及200-500atm的范围,且进入合成塔的N
C以及200-500atm的范围,且进入合成塔的N 和H
和H 的体积比为1:3,经科学测定,在相应条件下,N
的体积比为1:3,经科学测定,在相应条件下,N 和H
和H 反应所得氨的平衡浓度(体积分数)如下表所示。而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
反应所得氨的平衡浓度(体积分数)如下表所示。而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
|
|
200atm |
600atm |
500 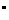 C C |
19.1% |
42.2% |
A、表中所测数据有明显误差 B、生产条件控制不当
C、氨的分解速率大于预测值 D、合成塔中的反应并未达平衡
答案:D
16. 在某化学平衡中,改变温度(其他条件不变),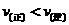 ,随着时间的推移,在新条件下建立起新的平衡,此时反应物的浓度一定
( )。
,随着时间的推移,在新条件下建立起新的平衡,此时反应物的浓度一定
( )。
A.大于生成物浓度
B.小于生成物浓度
C.与生成物浓度相等
D.大于原平衡时该物质的浓度
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com