
题目列表(包括答案和解析)
10.室温下,等体积0.5mol/L的①KCl ②FeCl3 ③HF ④Na2CO3四种物质的水溶液中,所含阳离子数目由多到少的顺序是
A.④①②③ B.③①②④ C.①④③② D.④②①③
9.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用 25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
8.25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=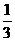 y,则x为
y,则x为
A.2 B.4 C.3 D.5
7. 25℃在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
6.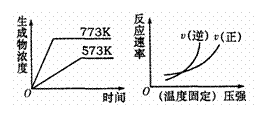 下列反应中符合下图图象的是
下列反应中符合下图图象的是
 A.N2(g)
+3H2(g) 2NH3(g) △H= -Q1kJ·mol-1(Q1>0)
A.N2(g)
+3H2(g) 2NH3(g) △H= -Q1kJ·mol-1(Q1>0)
 B.2SO3(g) 2SO2(g)+O2(g) △H= + Q2kJ·mol-1(Q2>0)
B.2SO3(g) 2SO2(g)+O2(g) △H= + Q2kJ·mol-1(Q2>0)
 C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H= -Q3kJ·mol-1(Q3>0)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H= -Q3kJ·mol-1(Q3>0)
 D.H2(g)
+CO(g) C(s)+H2O(g) △H= +Q4kJ·mol-1(Q4>0)
D.H2(g)
+CO(g) C(s)+H2O(g) △H= +Q4kJ·mol-1(Q4>0)
5.能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的离子组是
A.Na+、H+、Cl-、NO3- B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、Cl-、SO42- D.Cu2+、S2-、Br-、ClO-
4.下列变化不能用勒夏特列原理解释的是
A.红棕色的NO2加压后颜色先变深再变浅
B.KMnO4溶液中加硫酸酸化
C.用Na2CO3溶液处理锅炉水垢,使CaSO4转化为CaCO3
D.热的纯碱溶液去污效果好
3.下列说法不正确的是 A.向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B.加热饱和的二氧化碳水溶液,溶液中pH增大
C.NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D.FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
2.下列方法能使电离平衡H2O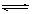 H+
+ OH-向右移动,且使溶液呈酸性的是
H+
+ OH-向右移动,且使溶液呈酸性的是
A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体
C.向 水中加入少量碳酸钠固体 D.将水加热到100℃
水中加入少量碳酸钠固体 D.将水加热到100℃
1.对于反应2SO2(g)+O2(g) 2SO3(g) △H<0
,下列措施能增大正反应速率的是
2SO3(g) △H<0
,下列措施能增大正反应速率的是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com