
题目列表(包括答案和解析)
5.下列反应的离子方程式正确的是 ( )
 A.少量二氧化硫气体通入到漂白粉溶液中:
A.少量二氧化硫气体通入到漂白粉溶液中:
 Ca2++2 CIO-+SO2+H2O=CaSO3↓+2 HCIO
Ca2++2 CIO-+SO2+H2O=CaSO3↓+2 HCIO
 B.碳酸钠的水解:CO32- +2H2O
B.碳酸钠的水解:CO32- +2H2O H2CO3+2OH-
H2CO3+2OH-
 C.少量的钠投入足量的水中:Na+ 2 H2 O =Na++2OH-+H2↑
C.少量的钠投入足量的水中:Na+ 2 H2 O =Na++2OH-+H2↑
 D.向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:
D.向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:
 Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
4. 某短周期元素的最高价氧化物所对应的水化物的化学式为HxROy,气态氢化物的化学式为HzR(或RHz)。已知1molHxROy比1molHzR质量多64g,下列说法不正确的是( )
某短周期元素的最高价氧化物所对应的水化物的化学式为HxROy,气态氢化物的化学式为HzR(或RHz)。已知1molHxROy比1molHzR质量多64g,下列说法不正确的是( )
A.2y-x+z=8 B.y=4
C.R一定是硫元素 D.R一定处于第三周期
3.已知25℃,AgI饱和溶液中,C(Ag+)=1.22 10-8mol/L,AgCl饱和溶液中,C(Ag+)=1.25
10-8mol/L,AgCl饱和溶液中,C(Ag+)=1.25 10-5mol/L,若在5ml含有KCl和
10-5mol/L,若在5ml含有KCl和 各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是 ( )
各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是 ( )
A.C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-)
B.C(K+)>C(NO3-)>C(Ag+)> (Cl-)>(I-)
C.C(NO3-)>(K+)> C(Ag+)> (Cl-)>(I-)
D.(K+)> C(NO3-)>C(Ag+)=(Cl-)+(I-)
2.被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH),下列说法正确的是 ( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0. 1 mol Zn完全溶解时,转移电子个数为1.204 ×1024
D.电池正极反应式为:2MnO2 +2e-十2H2O=2MnO(OH)+2OH-
1.化学与生活、社会密切相关,下列说法正确的是 ( )
A.维生素在天然食品中含量丰富,所以加工后的食品中维生素含量也高
B.2M+N=2P +2Q ,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求
C.世界卫生组织建议每天钠的摄取量少于2000 mg, 人们每天可摄取少于2 000 mg的金属钠
D.人体缺铁会得甲状腺肿大疾病
25.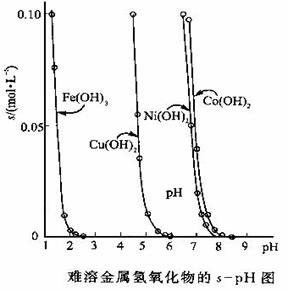 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
(1)pH=3时溶液中铜元素的主要存在形式是:____________(写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为_____
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,_____(能、不能)通过调节溶液pH的方法来除去,理由是__________________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式____________________________________。
(5)已知一些难溶物的溶度积常数如下表。
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_____除去它们。(选填序号)
A.NaOH B.FeS C.Na2S
命题:葛珊珊
校对:高二化学备课组
24.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
H++A2-
设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液 (C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液 (D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液 据此,填写下列空白(填代号) (1) C(H+)最大的是 ,最小的是 。
(2)C(H2A)最大的是 ,最小的是 。 (3)C(A2-)最大的是 , 最小的是
23.有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g)  xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”)。
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)平= 。
22.(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m____ n。
21.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
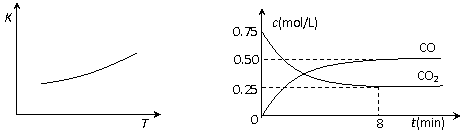
图甲 图乙
⑴该反应的平衡常数表达式K= 。
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。
8分钟内,CO的平均反应速率v(CO)= mol/(L·min)。
⑶下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强
 C.充入一定量CO
D.再加入一些铁粉
C.充入一定量CO
D.再加入一些铁粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com