
题目列表(包括答案和解析)
11.将0.05mol/L的盐酸溶液和未知浓度的NaOH溶液以1︰2的体积比混和,所得溶液的pH=12,用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时消耗NaOH溶液12.5mL,试求:
(1)NaOH溶液的物质的量的浓度 ;
(2)此一元弱酸的物质的量的浓度 ;
10.某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol·L-1 的盐酸和0.1mol·L-1 的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol·L-1 的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol·L-1 的盐酸溶液。
(1)写出实验过程的步骤(写编号顺序)______________。
(2)下图所示的仪器中配制0.1mol·L-1 盐酸溶液和0.1mol·L-1 氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。

(3)配制上述溶液应选用的容量瓶的规格是(填字母)__________________。
(A)50mL、50mL (B)100mL、100mL
(C)100mL、150mL (D)250mL、250mL
(4)写出有关的化学方程式_____________________________。
(5)胃药中含碳酸钙的质量是________。
9.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两电极板,通过导线与直流电源相连。回答以下问题:
 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X的电极材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
8.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )

A.a电极是负极
B.b电极的电极反应为:4OH- - 4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
7.在室温下,0.1mol/L 100ml的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离度减少,应采取( )
A 加入少量CH3COONa固体 B 通入少量氯化氢气体
C 提高温度 D 加入少量纯醋酸
6.要使水的电离平衡向右移动,且使pH<7,可采取的措施是( )
A 加少量NaOH B 加少量NH4Cl C 加少量盐酸 D 加热
5.下列操作中,能使电离平衡H2O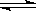 H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
(A)向水中加入NaHSO4溶液 (B)向水中加入Al2(SO4)3溶液
(C)向水中加入Na2CO3溶液 (D)将水加热到100℃,使pH=6
4.将0.03molCl2缓缓通入含0.02molH2SO3和 0.02molHBr的混和溶液中,在此过程中,溶液中的[H+]与Cl2用量的关系示意图是(溶液的体积不变)( )


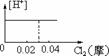
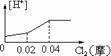
A B C D
3.已知同温同浓度时①H2CO3比H2S电离度大,②H2S比HCO3-电离度大,则下列反应不正确的是( )
(A)Na2CO3+H2S=NaHCO3+NaHS
(B)Na2S+H2O+CO2=NaHS+NaHCO3
(C)2NaHCO3+H2S=Na2S+2H2O+2CO2
(D)2NaHS+H2O+CO2=Na2CO3+2H2S
2.在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,则原溶液可能是( )
A.HCl溶液 B.NaOH溶液 C.KCl溶液 D.KOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com