
题目列表(包括答案和解析)
19. 可逆反应:H2 (g)+I2
(g)
2HI(g) 在一定的条件下,反应0.3
可逆反应:H2 (g)+I2
(g)
2HI(g) 在一定的条件下,反应0.3
混合物中各组分的浓度(mol/L)与时间t(min)的变化 0.2
曲线如图所示,根据图示,回答: 0.1
⑴时间t1的意义是 。
⑵在时间0-t1的间隔里,v(H2)= 。 t1
⑶ 此平衡状态下,I2的转化率为 。
17. 在某种条件下,容器中,有如下平衡反应A
+4B 2C+D
△H>O。此时A、B、C的物质的量均为amol,而D的物质的量为dmol。
在某种条件下,容器中,有如下平衡反应A
+4B 2C+D
△H>O。此时A、B、C的物质的量均为amol,而D的物质的量为dmol。
⑴改变a的取值,在通过改变反应条件,可以使反应从新达到平衡并限制达新的到平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围是 (用a和d的关系式表示)
⑵如果要使此反应重新建立的平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是
A、 升高反应温度 B、增大反应容器内压强 C、增大反应容器容积
D、降低反应温度 E、减小反应容器内压强 F、减小反应容器体积
 18某反应A+B C在任意时刻的正、逆反应速率都可用v(正)、v(逆)表示,:
18某反应A+B C在任意时刻的正、逆反应速率都可用v(正)、v(逆)表示,:
v(正)=k×c(A) ×c(B)v(逆)=k2×c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
⑴上述反应达到平衡时,三种物质的物质的量浓度关系可表示为 。
⑵在300K时,开始反应的A、B的浓度均为0.1mol/L,达平衡时B的转化率为50%,则k1、k2之间的关系是 。
 ⑶升高温度k1、k2的变化是
,k1/k2增大,说明正反应是
⑶升高温度k1、k2的变化是
,k1/k2增大,说明正反应是
(填“放热”或 “吸热”)反应。 0.4
16. 恒温下,将amolN2和bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 +3H2 2NH3
恒温下,将amolN2和bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 +3H2 2NH3
⑴若反应在达平衡前的某时刻,t时,nt(N2)=13mol nt(NH3)=6mol, a 。
⑵反应达平衡时,混合气体的体积为726.8L(标准状况)其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为 。
 ⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)n始:n平=
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)n始:n平=
⑷原混合气体中a:b=
⑸达到平衡时,N2和H2的转化率之比为
⑹平衡混合气体中nN2: nH2 :n(NH3)=
15.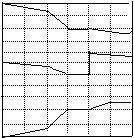
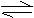 在一定温度下,2SO2
(g) +O2(g) 2 SO3(g)
△H∠0
0.20mol
在一定温度下,2SO2
(g) +O2(g) 2 SO3(g)
△H∠0
0.20mol
⑴写出该反应的化学平衡常数表达式K= SO2
⑵降低温度,该反应K值 SO2转化率
化学反应速率 (“增大”“减小”或“不变”0.10mol O2
⑶600℃时,在一密闭的容器中,将二氧化硫和氧气混合,
反应过程中二氧化硫、氧气、三氧化硫物质的量变化如图 SO3
所示,反应处于平衡的时间是
0 5 10 15 20 25 30
⑷据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达),10-15min的曲线变化的原因可能是 (填写编号)
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
14.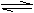 对于可逆反应CO(g) +H2O(g) CO(g)+H2(g) △H∠0在850℃时,KC=1
对于可逆反应CO(g) +H2O(g) CO(g)+H2(g) △H∠0在850℃时,KC=1
(1)到900℃,达到平衡后KC (填“>“<”=)
⑵850℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01mol·L‑1
c(H2O)=0.03mol·L‑1 c(CO2)=0.01mol·L‑1 c(H2)=0.05mol·L‑1.则反应开始时,H2O的消耗速率比生成速率 (填“大“小”或“不能确定”)。
⑶恒温恒容时,若向容器中充入适量的H2S气体,则重新达到平衡时,CO的反应速率比充入H2S之前 (填“大“小”或“不能确定”),理由是
13.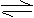 在水溶液中的反应:2I-
+ 2Fe3+
2 Fe2++I2 .
在水溶液中的反应:2I-
+ 2Fe3+
2 Fe2++I2 .
反应的平衡常数表达式为KC= .当上述反应达到平衡后,加入CCl4萃取I2且温度不变,上述平衡向 (填“向左”“向右”或“不变”)移动。
 上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+),且已知下列数据(浓度与反应速率的关系)
上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+),且已知下列数据(浓度与反应速率的关系)
|
|
c(I-)/mol/L |
c(Fe3+)/mol/L |
v/mol·s-1 |
|
|
0.20 |
0.80 |
0.032k |
|
|
0.60 |
0.40 |
0.144k |
|
|
0.80 |
0.20 |
0.128k |
通过所给的数据计算得知;在v=kcm(I-)·cn(Fe3+)中,m、n的值为
A.m=1 n=1B.m=1 n=2C.m=2 n=1D.m=2 n=2
I-浓度对反应速率的影响 (填“>”、“<”、“=”)Fe3+ 浓度对反应速率的影响。
12.将等物质的量的A、B、C、D四种物质混合,发生如下反应,
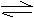 aA+bB cC(s)+dD。当反应进一定时间后测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡。
aA+bB cC(s)+dD。当反应进一定时间后测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡。
该化学方程式个物质的系数为a b c d 。
若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质聚集状态:
A. B C D .
若只升高温度,反应一段时间后,测知四种物质的量又达到相等,测该反应为 反应 (填“放热”或“吸热”)
11.关于I2 + H2 ==2HI的反应历程如下
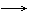
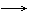 ①I2 2I ② H2
+2I 2HI
①I2 2I ② H2
+2I 2HI
 关于CH2=CH-CH=CH2 +CH2=CH2 C6H10
(环己烯)的反应历程如下
关于CH2=CH-CH=CH2 +CH2=CH2 C6H10
(环己烯)的反应历程如下
 ③CH2=CH-CH=CH2
+CH2=CH2 C6H10(环己烯)
③CH2=CH-CH=CH2
+CH2=CH2 C6H10(环己烯)
根据上述信息回答下列各题;
11上述反应中,属于基元反应的是 (用序号代码表示)
⑵上述反应中,属于复杂反应的是 (写方程式)
⑶上述反应中,属于复杂反应的是 (写方程式)
10.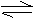 放热反应2NO(g)+O2
(g) 2NO2
(g)达平衡后,若分别采取下列措施;①增大压强
②减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向产物方向移动的是
放热反应2NO(g)+O2
(g) 2NO2
(g)达平衡后,若分别采取下列措施;①增大压强
②减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向产物方向移动的是
A.①②③ B②③④ C③④⑤ D①②⑤ ⑤
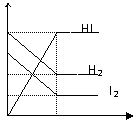
9.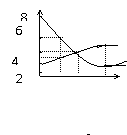 在某一温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是
在某一温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是
 A.反应的化学方程式为2M N
M
A.反应的化学方程式为2M N
M
B.t2时正逆反应速率相等,达到平衡 N
C.t3时正反应速率大于逆反应速率 t1 t2 t3
D.t1时,N的浓度是M浓度的2倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com