
题目列表(包括答案和解析)
5. 已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(l)所放出的热量为74kJ时,所需要空气在标况下的体积约为(空气中N2:O2体积比为4:1计) ( )
A.37.24L B.18.62L C.9.3L D.20.50L
4. 在100g炭不完全燃烧所得气体中CO和CO2的体积比为1:2.已知:
C(s)+1/2O2(g)=CO(g);△H1=-110.35kJ/mol
CO(g)+1/2O2= CO2(g);△H2=-282.57kJ/mol
则与100g炭完全燃烧相比,损失的热量是。 ( )
A.392.93kJ B.2489.42kJ C.784.92kJ D.3274.3kJ
3.有如下三个反应方程式
H2(g)+1/2O2(g)=H2O(g);△H=akJ/mol
H2(g)+1/2O2(g)=H2O(l);△H=bkJ/mol
2H2(g)+O2(g)=2H2O(l); △H=ckJ/mol
关于它们的下列叙述正确的是( )
A. 它们都是吸热反应 B. a、b、c均为正值
C. a=b D. 2b=c
2. 根据热化学方程式:S(l)+O2(g) SO2(g);
△H= -293.23kJ/mol分析下列说法中正确的是(
)
根据热化学方程式:S(l)+O2(g) SO2(g);
△H= -293.23kJ/mol分析下列说法中正确的是(
)
 A.S(s)+O2(g) SO2(g),反应放出的热量大于293.23kJ/mol
A.S(s)+O2(g) SO2(g),反应放出的热量大于293.23kJ/mol
 B.S(g)+O2(g) SO2(g),反应放出的热量小于293.23kJ/mol
B.S(g)+O2(g) SO2(g),反应放出的热量小于293.23kJ/mol
C.1mol SO2的键能的总和小于1mol硫和1mol氧气的键能之和
D.1mol SO2的键能的总和大于1mol硫和1mol氧气的键能之和
1.下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应只能在加热的条件下才能进行
24.常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为多少?
23.用酸碱中和滴定的方法测定NaOH和Na2CO3
的混合液中的NaOH含量时,可先在混合
液中加过量的BaCl2溶液,使Na2CO3完全变
成BaCO3沉淀,然后用标准盐酸滴定(用酚
酞作指示剂),试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3沉淀溶解而能测
定NaOH的含量? 。
(2)滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则能否由此准确
地计算出结果? 。
(3)能否改用甲基橙作指示剂? ,若用甲基橙作指示剂,则测定结果如何? 。
22.如图所示,若电解5min时铜电极质量增加2.16g,试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化:A池________,B池_______,C池________。
 ⑶ 通过5min时,B中共收集224mL气体(标
⑶ 通过5min时,B中共收集224mL气体(标
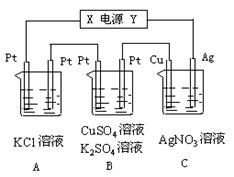 况),溶液体积为200mL,则通电前硫酸铜溶
况),溶液体积为200mL,则通电前硫酸铜溶
液的物质的量浓度为______________。
⑷ 若A中KCl溶液的体积也是200mL,电解
后溶液的pH = ______。
21.某二元酸H2A的电离方程式是:H2A=H++HA-,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)Na2A溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(2)NaHA溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)若0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能 0.11mol·L-1(填“<”、“>”或“=”=,理由是: ;
 (4)0.1mol·L-1NaHA溶液中各离子浓度由大到小的
(4)0.1mol·L-1NaHA溶液中各离子浓度由大到小的
顺序是 。
20.如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起
始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生下
列反应:2X(g)+2Y(g) 3Z(g)+2W(g)(正反应是放热反应),达到平衡(Ⅰ)
3Z(g)+2W(g)(正反应是放热反应),达到平衡(Ⅰ)
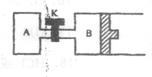 时,V(B)=1.2aL。请回答:
时,V(B)=1.2aL。请回答:
(1)B中X的转化率α(X)B为 ;
(2)打开K,过一段时间重新达到平衡(Ⅱ)时,
B的体积为 (用的代数式表示,连接
管中气体体积不计)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com