
题目列表(包括答案和解析)
4.下列各图所表示的反应是吸热反应的是 ( )
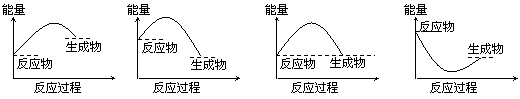
A B C D
3.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收热量为 ( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
2.下列过程一定释放出能量的是 ( )
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外
11. 利用盖斯定律回答下列问题:
 (1)已知热化学方程式:C(s、金刚石)+O2(g) CO2(g);
△H=-395.4kJ·mol-1
(1)已知热化学方程式:C(s、金刚石)+O2(g) CO2(g);
△H=-395.4kJ·mol-1
 C(s、石墨)+O2(g) CO2(g);△H=-395.4kJ·mol-1
C(s、石墨)+O2(g) CO2(g);△H=-395.4kJ·mol-1
由金刚石转化为石墨的热化学方程式为 ,由热化学反应方程式看来,更稳定的碳的同素异形体是 。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或几步完成这个总过程的热效应是相等的”观点来计算反应热。已知
 P4(s,白磷)+5O2(g) P4O10(s) △H= -2983.2kJ·mol-1
P4(s,白磷)+5O2(g) P4O10(s) △H= -2983.2kJ·mol-1
 P(s,红磷)+5/4O2(g) 1/4P4O10(s) △H= -738.5kJ·mol-1
P(s,红磷)+5/4O2(g) 1/4P4O10(s) △H= -738.5kJ·mol-1
 则白磷转化为红磷的热化学方程式为
;相同状况下,能量状态较低的是
;白磷的稳定性比红磷
(填“高”或“低”)
则白磷转化为红磷的热化学方程式为
;相同状况下,能量状态较低的是
;白磷的稳定性比红磷
(填“高”或“低”)
______年______月______日 星期_______
10.沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是( )
 A.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l); △H=+890kJ·mol-1
A.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l); △H=+890kJ·mol-1
 B.CH4(g)+2O2(g) CO2(g)+2H2O(l);
△H=-890kJ·mol-1
B.CH4(g)+2O2(g) CO2(g)+2H2O(l);
△H=-890kJ·mol-1
 C.CH4(g)+2O2(g) CO2(g)+2H2O(l)
△H=+890kJ·mol-1
C.CH4(g)+2O2(g) CO2(g)+2H2O(l)
△H=+890kJ·mol-1
 D.1/2CH4(g)+O2(g) 1/2CO2(g)+H2O(l);
△H=-890kJ·mol-1
D.1/2CH4(g)+O2(g) 1/2CO2(g)+H2O(l);
△H=-890kJ·mol-1
9.在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水放热22.68kJ,下列热化学方程式正确的( )
A.CH3OH(l)+3/2O2=CO2(g)+2H2O(l);△H =+725.8kJ/mol
B.2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =-1452kJ/mol
 C.2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =-725.8kJ/mol
C.2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =-725.8kJ/mol
D.2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =+1452kJ/mol
8.在一定条件下CO、CH4燃烧热化学方程式分别为
CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol
CH4(g)+2O2(g)-→CO2(g)+H2O(l);△H=-890kJ/mol
现有标况下的89.6LCO、CH4组成的混合气体在上述条件下完全燃烧时释放的热量为2953kJ,则CO、CH4的体积比为 ( )
A.1:3 B.3:1 C.1:2 D.2:1
7.已知方程式2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ/mol,则关于方程式
2H2O(l)=2H2(g)+O2(g); 有关△H2的说法正确的是 ( )
A.方程式中化学计量数表示分子数 B.该反应的△H2大于零
C.该反应△H2=-571.6kJ/mol D.该反应与上述反应属于可逆反应
6.含NaOH20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com