
题目列表(包括答案和解析)
2.反应:A  2B中,A.B的浓度变化如图所示。则2min以内的平均反应速率为
2B中,A.B的浓度变化如图所示。则2min以内的平均反应速率为
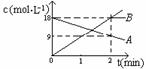 A.v(A) = 9
mol/(L·min) B.v(A) = 4.5 mol/(L·min)
A.v(A) = 9
mol/(L·min) B.v(A) = 4.5 mol/(L·min)
C.v(B) = 18 mol/(L·min) D.v(B) =2.25mol/(L·min)
1.可逆反应4NH3+5O2==4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的反应速率为
 A.V(O2)=0.001mol·L-1·S-1 B.V(NO)==0.008 mol·L-1·S-1
A.V(O2)=0.001mol·L-1·S-1 B.V(NO)==0.008 mol·L-1·S-1
C.V(H2O)==0.004 mol·L-1·S-1 D.V(NH3)==0.002 mol·L-1·S-1CD
12.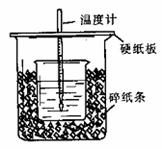 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
 该用品能否用铁质用品代替 ,原因是①
②
该用品能否用铁质用品代替 ,原因是①
②
(2)图示中用品填加后的装置叫 。
(3)烧杯间填满碎纸条的作用是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)。
已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kj的热量,写出上述反应的热化学方程式
(6)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值
(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C = 4.18 J (g.·℃)则该反应的中和热为△H=______________;
______年______月______日 星期_______
11.化学反应N2+3H2 = 2NH3的能量变化如题13图所示,该反应的热化学方程式是 ( )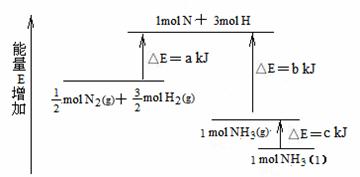
A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b-a)kJ·mol-1
C.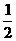 N2(g)+
N2(g)+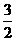 H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
D.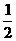 N2(g)+
N2(g)+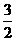 H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1
H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1
10.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) ;△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) ;△H=―1160 kJ·mol一1。
下列选项正确的是 ( )
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol
9.右图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )
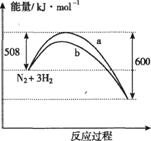
 A.该反应的热化学方程式为:N2+3H2
A.该反应的热化学方程式为:N2+3H2 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2Kj
则184>Q2>2Q1
8.完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是( )
A. 0.2Q B. 0.1Q C. 5Q D. 10Q
7.已知化学反应2C(s)+O2(g) 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)  2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
( )
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
( )
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定高于28gCO所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
6.强酸与强碱的稀溶液发生中和反应生成1mol水热效应:H+(aq)+ OH-(aq)== H2O(l) ;△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是 ( )
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1<△H2<△H3 D.△H1>△H3>△H2
5.已知 (1)H2(g)+1/2O2(g)=H2O(g) △H1=a kJ/mol
(2)2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) △H3=c kJ/mol
(4)2H2(g)+O2(g)=2H2O(l) △H4=d kJ/mol
表示氢气燃烧热的是 ( )
A.△H1 B. △H2 C. △H3 D.△H4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com