
题目列表(包括答案和解析)
1. 将纯水加热至较高温度,下列叙述正确的是 ( )
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
11. 向1.0 L pH = 12的Ba(OH)2溶液中,逐滴加入1.25×10-3 mol/L 的NaHSO4溶液,使溶液中的Ba2+ 恰好完全沉淀时(忽略溶液混合时体积的变化),所得溶液pH =______,发生反应的离子方程式为:__________________________________。当溶液呈中性时,加入NaHSO4溶液的体积是________L。
______年______月______日 星期_______
10.(1)现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是:第一步,把小块pH试纸放在表面皿(或玻璃片)上,第二步,___________________________________________________________________;
(2)该纯碱溶液呈碱性的原因(用离子方程式表示)是 __________________________,你认为该溶液pH的范围一定介于 7至________________之间;
(3)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:____________________________________________________。
9. 已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO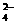 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
8. 将pH=10的NaOH溶液与pH=12的NaOH溶液等体积混合后,溶液中c(H+)(单位:mol/L)最接近于 ( )
A.0.5×(10-10+10-12) B.10-10+10-12
C.5×10-11 D.2×10-12
7. 在常温下,物质的量浓度分别为c1 mol·L-1和c2 mol·L-1的两种稀氨水,若c1溶液的pH比c2溶液的pH大1,则下面的关系正确的是 ( )
A.c1: c2 = 10 : 1 B.c(OH-)1 : c(OH-)2 = 2 : 1
C.c(H+)1 : c(H+)2 = 1 : 10 D.c1 <10c2
6. 有a 、b 、c 、d 四种一元酸溶液,进行以下实验:
① 摩尔浓度相同的a 、c 溶液,分别加入甲基醇溶液后,a 溶液变为黄色,c 溶液无明显变化; ② b 、c 对应的钠盐溶液摩尔浓度相同时, b 的钠盐溶液的pH值小于c 的钠盐溶液的pH值; ③ a 酸与d 酸对应的钠盐 反应成d 酸和a 酸对应的钠盐。由此确定四种酸的酸性由强到弱的顺序为 ( )
A.a > c > d > b B.b > c > a > d
C.d > a > b > c D.c > d > a > b
5. 在相同温度、压强条件下,将同体积的CO2 分别通入下列溶液中,能得到 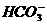 浓度最大的是 ( )
浓度最大的是 ( )
A.过量氨水溶液 B.过量饱和Na2CO3 溶液
C.过量CH3COOH 溶液 D.过量蒸馏水
4. 向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是 ( )
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
3. 常温下测得无色溶液中由水电离出的C(H+)=1×10-13mol·L-1,又知该溶液中还有Na+、Cl-、 ,那么该溶液中还可能存在的离子是 ( )
,那么该溶液中还可能存在的离子是 ( )


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com