
题目列表(包括答案和解析)
12. 氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( )
A. NaOH B. NH4Cl C. MgSO4 D. NaHSO4
11. 下表是五种银盐的溶度积常数(25℃):
|
化学式
|
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
10.
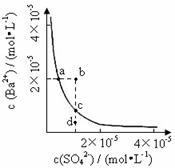 (2008山东理综,15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
(2008山东理综,15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
提示:BaSO4(s)  Ba2+(aq)+SO42-
(aq)的平衡常数Ksp=c(Ba2+)•c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-
(aq)的平衡常数Ksp=c(Ba2+)•c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
9.已知:Ksp(Ag2SO4)=1.4×10-5mol3•L-3,Ksp(Ag2CO3)=8.1×10-12mol3•L-3,Ksp(AgCl)=1.8×10-10mol2•L-2,Ksp(AgI)=8.3×10-17mol2•L-2在下列各饱和溶液中,c(Ag+)由大到小的顺序是( )
A. Ag2SO4>AgCl>Ag2CO3>AgI B. Ag2SO4>Ag2CO3>AgCl>AgI
C. Ag2SO4>AgCl>AgI>Ag2CO3 D. Ag2SO4>Ag2CO3>AgI>AgCl
8. 对于难溶盐MX,其饱和溶液中M+和X-浓度之间的关系为Ksp=c(M+)•c(X-),现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是 ( )
①20mL0.01mol•L-1KCl溶液;②30mL0.02mol•L-1CaCl2溶液;③40mL0.03mol•L-1HCl溶液;④10mL蒸馏水;⑤50mL0.05mol•L-1AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
7. 下列有关Ksp的叙述中正确的是( )
A. Ksp越大说明电解质的溶解度越大
B. Ksp只与电解质的本性有关,而与外界条件无关
C. Ksp表示难溶强电解质在水中达到沉淀溶解平衡时,溶液中离子浓度幂之积
D. Ksp的数值只与难溶电解质的性质和温度有关
6. 有关AgCl沉淀的溶解平衡的说法正确的是( )
A. AgCl沉淀的生成和溶解仍在不断进行,但速率相等
B. AgCl不溶于水,溶液中没有Cl-和Ag+
C. 升高温度,AgCl的溶解度增大,Ksp增大
D. 向AgCl饱和溶液中加入NaCl固体,AgCl的溶解度和Ksp都不变
5. 下列关于溶解平衡的说法不正确的是( )
A. 溶解平衡是一种动态平衡
B. 达到溶解平衡时,物质沉淀和溶解的速率相同
C. 达到溶解平衡时,升高温度平衡将向溶解方向移动
D. 达到溶解平衡时,加入其他物质,溶解平衡一定不移动
4. 除去NaCl溶液中MgC12、CaC12的方法是( )
A. 将样品溶于蒸馏水,加入过量NaOH过滤后,加盐酸蒸发
B. 将样品溶于蒸馏水,加入过量 Na2CO3过滤后,加盐酸蒸发
C. 将样品溶于蒸馏水,加入过量Ca(OH)2过滤,然后加过量Na2CO3过滤,在滤液中加过量盐酸后蒸发
D. 用半透膜有选择地除去Ca2+、Mg2+
3. 下列说法不正确的是( )
A. 不溶于水的物质溶解度为0
B. 绝对不溶解的物质是不存在的
 C. 当残留在溶液中的离子浓度小于10-5 mol•L-1时就认为沉淀完全
C. 当残留在溶液中的离子浓度小于10-5 mol•L-1时就认为沉淀完全
D. 习惯上将溶解度小于0.01g的电解质称为难溶电解质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com