
题目列表(包括答案和解析)
13.陶土 氧化铁 通电时产生电泳现象,带相反电荷的胶体微粒,分别向两极移动,从而达到除杂目的
12. ①铁 增大 ②Mn
①铁 增大 ②Mn -e-===MnO
-e-===MnO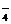 ③2K2MnO4+2H2O
③2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
11.①HNO3、Ba(NO3)2 ②AgNO3③HCl、BaCl2
14、(1) ① 由于c(H+)的变化使平衡向不同方向移动,发生不同方向的反应,电子移动方向不同 ② 2I-+2e=I2
(2) 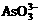 +H2O-2e-=
+H2O-2e-=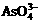 +2H+
+2H+
参考答案十九1.C 2.C 3.B 4.D 5.B 6.A 7.C 8.A 9.D 10.D
13.63.5
12.(1)64 x=2 n=3 (2)pH=1
11.(1)阳极:Fe-2e-===Fe2+ 阴极:2H++2e-===H2↑
(2)Cr2O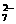 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
Cr3+、Fe3+与溶液中剩余的OH-结合成Cr(OH)3、Fe(OH)3
(3)不能。因为如果用石墨作电极,阳极产生Cl2,得不到Fe2+,缺少还原剂,则不能使Cr2O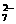 →Cr3+→Cr(OH)3↓,从而不能达到除去Cr2O
→Cr3+→Cr(OH)3↓,从而不能达到除去Cr2O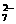 的目的。
的目的。
14.①构成原电池,负极铝加快腐蚀
②能 Cu–2e- == Cu2+ 2Fe3++2e-=2Fe2+
③见下图(其他合理答案均得分)
[解析](1)满足形式原电池的条件,可形成原电池,导致铝腐蚀加快。
(2)能。负极材料失电子:Cu-2e- =Cu2+
正极:2Fe3+ +2e- =2Fe2+
(3)设计时Cu做负极材料,电解质溶液中能提供H+失电子,不能有氧化性强于H+的粒子。
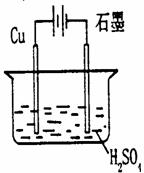
参考答案十八1.B 2.A 3.C 4.D 5.D 6.A 7.C 8.C 9.A 10.C
13.①4OH-–4e-=2H2O+O2↑
②H+放电,促进H2O的电离,从而使OH-浓度增大
③B
[解析]电解时,含氧酸根放电顺序在OH-放电之后,所以阳极反应式4OH- -4e- =2H2O+O2↑;电解开始后,阴极反应式:4H++4e-=2H2↑,H+由水提供,所以PH升高。B出口得到除杂后的KOH溶液。
12.O2 Hg2(NO3)2 Hg22++2e-=2Hg
[解析]电解硝酸盐时阳极发生的反应为4OH- -4e- = 2H2O+O2↑产生1molO2需转移4mol电子,则金属阳离子也产生4mole-,金属又为负价。所以,该盐必为Hg2(NO3)2,阴极反应为2Hg22++4e-=4Hg。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com