
题目列表(包括答案和解析)
4. 碱性电池具有容量大、放电电流大的特点,因此得到 广泛的应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O== Zn(OH)2(s)+ Mn2O3(s),下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池负极的电极反应式为:Zn-2e-+2OH-== Zn(OH)2
C. 电池工作时,电子由正极通外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
3. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
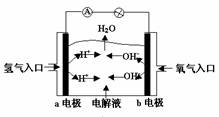
A. a电极是负极
B. b电极的电极反应为:4OH--4e-==2H2O+O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置
2. 锌锰干电池在放电时,电池总反应方程式可表示为:
Zn+2MnO2+2NH4+==Zn 2++ Mn2O3+2NH3+H2O
在电池放电时,正极(碳棒)上发生反应的物质是( )
A. Zn B. 碳棒 C. MnO2和NH4+ D. Zn 2+和NH4+
1. 下列有关化学电池的说法不正确的是( )
A. 化学电池是将化学能变成电能的装置
B. 一次电池的活性物质消耗到一定程度就不能使用了
C. 二次电池又称充电电池或蓄电池,放电后可以再充电,故可多次重复使用
D. 燃料电池是将燃料燃烧所放出的能量转化为化学能装置
0.005mol n
n(HNO3)=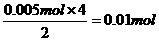

pH = -lg10-1 = 1


14、 (M)=n[R(NO3)x·yH2O]=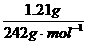 =0.005mol
=0.005mol
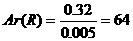 R的化合价=
R的化合价=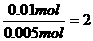 所以x=2
所以x=2
根据64+2(14+48)+18y=242 得y=3
(2)电解总反应为:
 2R(NO3)2+2H2O
2R + 4HNO3 +O2↑
2R(NO3)2+2H2O
2R + 4HNO3 +O2↑
2 4
13、(1) 被氧化 (2) 与铁屑、NaCl溶液构成原电池,加快铁屑的氧化作用 (3) NaCl溶于水,形成电解质溶液 (4) 负极:2Fe-4e-=2Fe2+;正极:2H2O+O2+4e-=4OH-;4Fe(OH)3+O2+2H2O=4Fe(OH)3
12、⑴①2H+ + 2e - = H2↑ 放出气体,溶液变红。 ②2Cl - - 2e - = Cl2 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。 ⑵①纯铜 Cu2+ + 2e - = Cu ②粗铜Cu - 2e - = Cu2+
15.0.283g 0.187g
参考答案二十1---------11 BCDCBDABDBC
14.(1)O2 466.7g (2)9.66%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com