
题目列表(包括答案和解析)
2.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是 ( )
A.PH3分子中有未成键的孤对电子
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P-H键是非极性键
1. 有关乙炔分子中的化学键描述不正确的是
( )
有关乙炔分子中的化学键描述不正确的是
( )
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
 C.每个碳原子都有两个未杂化的2p轨道形成π键
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
27、W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
。

26、1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键------三个O原子均等地享有这个电子。请回答:

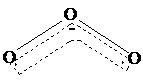
 (1)臭氧与氧气的关系是
(1)臭氧与氧气的关系是
 (2)写出下列分子与O3分子的结构最相似的是
(2)写出下列分子与O3分子的结构最相似的是
A.H2O B. CO2 C.SO2 D. BeCl2
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有
 对孤对电子。
对孤对电子。
(4)O3分子是否为极性分子 。(填是或否)
 (5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:



 PbS
+ O3 ====
PbSO4 + O2
PbS
+ O3 ====
PbSO4 + O2
 生成1mol O2的转移电子物质的量为
mol。
生成1mol O2的转移电子物质的量为
mol。
25. 在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是 ;
(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,3种分子的偶极矩由大到小的排列顺序是:
;
(3)实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是 构型,
BC13分子是 构型。
(4)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0。试画出两种异构体的构型图,并比较在水中的溶解度。

 构型图:
构型图:
淡黄色者 ,棕黄色者 ;
在水中溶解度较大的是 。
24. 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+
是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
 ⑴写出N2H62+在碱性溶液中反应的离子方程式
⑴写出N2H62+在碱性溶液中反应的离子方程式
。
⑵NH2-的电子式为 。
⑶N3-有 个电子。
 ⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式
。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式
。
⑸等电子数的微粒往往具有相似的结构,试预测N3-的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,
由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
21. 1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。22. (1)下列物质中,哪些形成分子内氢键,哪些形成分子间氢键?(填序号)
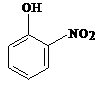
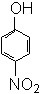
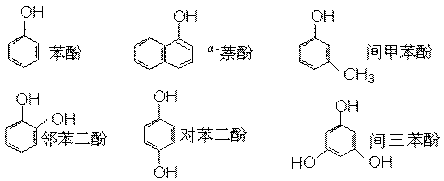
⑨HNO3 ⑩NH3
形成分子内氢键的有 ;形成分子间氢键有
(2)二聚甲酸解聚反应为:(HCOOH)2 → 2 HCOOH,该反应需吸收60KJ.mol-1的能量,此能量是断开___ _键所需的能量,所以此键的键能为___ _KJ.mol-1。
(3)氢键一般用X-H···Y表示。根据氢键形成的条件,可以推测还有____ 元素的原子可以代替氢原子而形成类似氢键的结构。
20. 关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
19.三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是
A. 三氯化硼液态时能导电而固态时不导电 B. 三氯化硼加到水中使溶液的pH升高
 C. 三氯化硼分子呈正三角形,属非极性分子 D. 三氯化硼遇水蒸气会产生白雾
C. 三氯化硼分子呈正三角形,属非极性分子 D. 三氯化硼遇水蒸气会产生白雾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com