
题目列表(包括答案和解析)
1.不同金属的冶炼,其冶炼方法也可能不同,主要原因是
A.金属在自然界的分布不同 B.金属在自然界的含量不同
C.金属在自然界的存在形式不同 D.金属的活动性不同
25.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生反应:
 N2(g) + 3H2(g) 2NH3(g)
N2(g) + 3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a= 。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量= 。
(3)原混合气体与平衡混合气体的总物质的量之比n(始)∶n(平)= 。
(4)原混合气体中,a∶b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)= 。
命题:汪莺 校对:汪莺
杭十四中二〇〇八学年第一学期期末考试
24.在溶液中进行某化学反应2A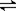 B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
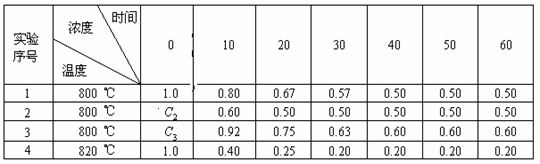
(1)在实验1,反应在10min-20min时间内平均速率(VA)为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”、“=”、“<”),且
C3 1.0 mol/L(填“>”、“=”、“<”)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。
23.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴ 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴
入几滴酚酞试液,则
① 电解池中X极上的电极反应是 。
在X极附近观察到的现象是 。
② Y电极上的电极反应式是 ,
检验该电极反应产物的方法是 。
⑵ 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
22.
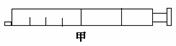 ⑴ 现有一透明的注射器针筒,充满NO2气体(如图甲),当推动活塞时,气体的颜色将
(填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙),NO2的浓度
(填“大于”、“等于”或“小于”)推压活塞前NO2浓度的2倍。当观察到
时,可确定针筒内已经达到了化学平衡状态。当活塞后拉时,通过针筒又吸进少量NO2气体,再前推活塞固定在图乙位置,NO2的转化率将
(填“增大”、“减小”、或“不变”)。
⑴ 现有一透明的注射器针筒,充满NO2气体(如图甲),当推动活塞时,气体的颜色将
(填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙),NO2的浓度
(填“大于”、“等于”或“小于”)推压活塞前NO2浓度的2倍。当观察到
时,可确定针筒内已经达到了化学平衡状态。当活塞后拉时,通过针筒又吸进少量NO2气体,再前推活塞固定在图乙位置,NO2的转化率将
(填“增大”、“减小”、或“不变”)。
⑵ 另有一透明的注射器针筒,充满H2、I2、HI气体(如图甲),当推动活塞时,气体的颜色将
(填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲
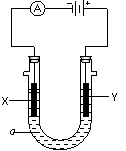 的一半时(如图乙,此时I2仍为气体),HI的浓度
(填“大于”、“等于”或“小于”)推压活塞前HI浓度的2倍。
的一半时(如图乙,此时I2仍为气体),HI的浓度
(填“大于”、“等于”或“小于”)推压活塞前HI浓度的2倍。
21.A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
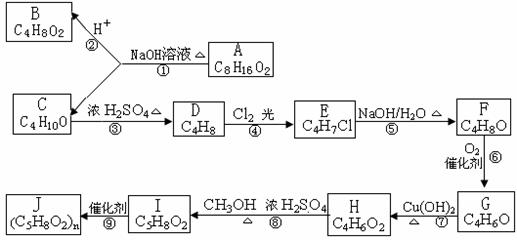
(1)B和C均为有支链的有机化合物,B的结构简式为 ;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为 。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为 。
(3)写出⑤的化学反应方程式 。
⑨的化学反应方程式 。
(4)①的反应类型 ,④的反应类型 ,⑦的反应类型 。
(5)与H具有相同官能团的H的同分异构体的结构简式为 。
20. 在一定条件下,固定容积的密闭容器中存在反应:2NO2(g) O2(g) + 2NO(g) ΔH>0,
在一定条件下,固定容积的密闭容器中存在反应:2NO2(g) O2(g) + 2NO(g) ΔH>0,
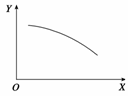 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A.当X表示温度时,Y表示NO 的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
19.为了鉴定溴乙烷中溴元素的存在,试分析①-⑥的各步实验,其中操作顺序合理的是
① 加入AgNO3溶液 ② 加入NaOH溶液 ③ 加热 ④ 加入蒸馏水
⑤ 用HNO3酸化溶液 ⑥ 加入NaOH醇溶液
A.①②③⑤ B.②③⑤① C.⑥③①⑤ D.④②⑤③
18.下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀
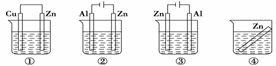 速率由快到慢的正确顺序是
速率由快到慢的正确顺序是
A.③①④② B.①②④③
C.①②③④ D.②①④③
17. 在某温度下,C和H2O (g) 在密闭容器中发生下列反应:C(s)
+ H2O(g)
CO(g) + H2(g)
在某温度下,C和H2O (g) 在密闭容器中发生下列反应:C(s)
+ H2O(g)
CO(g) + H2(g)
 CO(g) + H2O(g) CO2(g)
+ H2(g) 当反应达到平衡时,测得c (H2) = 1.9 mol·L-1,
CO(g) + H2O(g) CO2(g)
+ H2(g) 当反应达到平衡时,测得c (H2) = 1.9 mol·L-1,
c (CO) = 0.1 mol·L-1,则CO2的浓度为
A.0.1 mol·L-1 B.0.9 mol·L-1 C.1.8 mol·L-1 D.1.9 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com