
题目列表(包括答案和解析)
4.(6分)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合而得,则溶液的
pH 7(选填“大于或等于”、 “小于或等于”、 “等于”)。
②若溶液pH>7,则c (Na+) c(A-)(选填“>”、 “<”、 “=”)。
③若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL。混合而得,则下列说法中,正确的是
(填选项符号字母)。
A.若反应后溶液呈中性,则反应后溶液中[H+]+ [OH-]=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
3.(4分)某温度时,在2L的密闭容器中,X、Y、Z三种物质的物
质的量随时间的变化曲线如图所示。
由图中所给数据进行分析,该反应的化学方程式为:
___________________________________________;
反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= _mol·L-1·min-1。
2.(4分)工业上由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2 →(步骤Ⅰ)TiCl4  (步骤Ⅱ)Ti
(步骤Ⅱ)Ti
(1)写出步骤Ⅱ中TiCl4→Ti的化学反应方程式 。
(2)已知:①C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ·mol-1。

1.(2分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量。请写出该反应的热化学方程式:
________________________________________。
18.体积相同的甲、乙两个容器,分别都充等量的SO2和O2,在相同温度下发生反应:
2SO2(g)+O2(g) 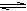 2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则乙中SO2的转化率是转化率是下列的
( )
2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则乙中SO2的转化率是转化率是下列的
( )
A.等于a% B.大于a% C.小于a% D.无法判断
高 二 化 学 试 题(B卷)
第Ⅱ卷 (非选择题 共46分)
17.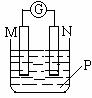 如右图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细,
如右图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细,
下表所列M、N、P物质中,可以组合成该装置的是( )
|
|
M |
N |
P |
||
|
A |
锌 |
铜 |
稀硫酸 |
||
|
B |
铜 |
铁 |
稀盐酸 |
||
|
C |
银 |
锌 |
|
||
|
D |
锌 |
铁 |
硝酸铁溶液 |
16.今有反应2A(g)  B(g)+C(g) ΔH>0。 从反应开始到t1 s时达到平衡状态,在t2 s时,由于条件变化使平衡破坏,到t3 s时又达平衡,下图表示在上述过程中物质浓度与反应时间的关系,试判断图中引起
B(g)+C(g) ΔH>0。 从反应开始到t1 s时达到平衡状态,在t2 s时,由于条件变化使平衡破坏,到t3 s时又达平衡,下图表示在上述过程中物质浓度与反应时间的关系,试判断图中引起
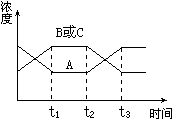 t2~t3变化的是( )
t2~t3变化的是( )
A.降低温度
B.增大压强
C.加大B或C的浓度
D.使用了催化剂
15.只用一种试剂就可以鉴别FeCl3、AlCl3、MgCl2 、NH4Cl和 NaCl五种物质的溶液,这种试剂是( )
A. 氢氧化钠溶液 B.盐酸 C. 氨水 D.硫氰化铵溶液
14. 当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH-,为使Mg(OH)2固体的量减少,可加入
( )
当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH-,为使Mg(OH)2固体的量减少,可加入
( )
A. NH4NO3 B. Na2S C. MgSO4 D. CH3COONa
13. 可逆反应:3A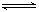 3B+C,△H>0 ,已知反应物A为气态物质,随着温度升高,三营体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是 ( )
3B+C,△H>0 ,已知反应物A为气态物质,随着温度升高,三营体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是 ( )
① B和C可能都是固体 ②B和C一定都是气体
③ 若C为固体,则B一定是气体 ④ B和C可能都是气体
A.只有①② B. 只有②③ C. 只有①④ D.只有③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com